| Tartu Tervishoiu Kõrgkool Bioanalüütika labori kvaliteedikäsiraamat | ||
| Koostas: | Kadri-Elise Lasn | Kuupäev 15.01.2019 |
| Kinnitas: | Mare Remm | Kuupäev 15.01.2019 |
3.7.1 MEETODI ULATUS
In Vitro: põsekaape värvimine Papanicolaou järgi
3.7.2 MEETODI KEHTIVUS
Meetod kehtib kasutamiseks õppetöös: JAH
Meetod kehtib kasutamiseks teadusuuringute teostamisel: JAH
Meetod kehtib kliiniliseks kasutamiseks patsiendi proovide teostamisel: EI
3.7.3 EESMÄRK
Käesolev juhend on kohandatud Tartu Tervishoiu Kõrgkooli patoloogia labori tehnoloogia aine raames kasutamiseks. Juhendi eesmärgiks on kirjeldada põsekaape tsütoloogilise preparaadi valmistamist, värvimist Papanicolaou meetodil ning lõpptulemuse hindamist.
Juhendi läbitöötamise järgselt üliõpilane:
- arendab üliõpilane juhendi järgimise oskust;
- kasutab vajalikke töövahendeid;
- tunneb juhendis ja tööprotsessis kasutatud terminoloogiat;
- valmistab vajaminevaid lahuseid;
- oskab valmistada põse limaskesta rakkudest preparaati;
- teostab Papanicolaou värvingu;
- tagab enda, kaastöötajate ja keskkonna ohutuse;
- hindab valminud preparaadi värvingu kvaliteeti.
3.7.4 TEGEVUSJUHIS
3.7.4.1 Proovimaterjal
Uuritavaks materjaliks on põse limaskesta rakud, mis kogutakse spetsiaalse tsütoharjaga KITO-BRUSH ning kantakse seejärel laiali alusklaasile.
3.7.4.2 Töövahendid
Preparaadi valmistamise ja fikseerimise juures on vajalik:
- tsütohari;
- plastiktops;
- kraanikauss;
- alusklaas;
- harilik pliiatsit alusklaasi markeerimiseks;
- pintsetid;
- värvivann;
- taimer.
Värvimise ja viimistlemise protsessis on vajalikud:
- 100 ml Erlenmayer’i kolb;
- 100 ml püstised vannid värvimiseks ja dehüdreerimiseks (17);
- mõõtesilindrid (3);
- taimer;
- kleepsud ja marker anumate märgistamiseks;
- tõmbekapp;
- pintsetid;
- katteklaas.
3.7.4.3. Ohutusnõuded ja jäätmekäitlus
Kogu tööprotsessi jooksul kanda kindaid ning laborikitlit. Vältida kemikaalide sattumist nahale ja limaskestadele (tabel 1). Töötada tõmbekapi all, vältida kemikaali aurude sissehingamist. Kasutatud värvilahused ja reagendid koguda vastava märgistusega jäätmenõudesse, millel on vastava kemikaali nimetus. Lahuseid ei tohi valada kanalisatsiooni, need saadetakse hiljem jäätmekäitlusesse.
| Isopropanool, C3H8O |    |
| Etanool, C2H6O |    |
| OG6 värv — Papanicolaou oranž, H3(Mo12O40)P × H2O |   |
| Papanicolaou polü-kromaatiline värv EA 50, H3[P(W3O10)4]CH3COOH |      |
| Harris hematoksüliin |  |
| Ammooniumhüdroksiid, NH4OH |    |
| Ksüleen, C8H10 |     |
Tabel 1. Vajalikud reagendid ja nendega seotud ohud:
3.7.5 TÖÖLAHUSTE VALMISTAMINE
3.7.5.1 Ettevalmistus
Võtta Erlenmeyer’i koonilised kolvid, märgistada need kleepsude abil valmistatavate lahuste nimetustega. Nimetused kleepida ka värvivannidele. Valmista lahused järgnevalt.
3.7.5.2 70% etanool
Mõõta mõõtesilindriga 73 ml 95% etanooli ning valada värvivanni. Seejärel mõõta mõõtesilindriga 27 ml destilleeritud vett ning valada etanoolile juurde.
3.7.5.3 80% etanool
Mõõta mõõtesilindriga 83 ml 95% etanooli ning valada värvivanni. Seejärel mõõta mõõtesilindriga 17 ml destilleeritud vett ning valada etanoolile juurde.
3.7.5.4 3% NH4OH 70% etanoolis
Valmistada 100 ml 70% etanooli Erlenmayer’i kolbi. Sellest mõõta mõõtesilindriga 97 ml ning valada värvivanni. Mõõta mõõtesilindriga 3 ml NH4OH ning valada 70% etanooli juurde värvivanni.
3.7.5.5 Harris hematoksüliin ja Papanicolaou värvid
Harris hematoksüliin ja mõlemad Papanicolaou värvinguks vajalikud värvid on olemas valmis kujul. Enne värvivanni valamist tuleb veenduda, et värvid oleksid sademeta. Värvivanni valada 100 ml värvilahust.
3.7.6 VÄRVITAVATE RAKKUDE KOGUMINE JA FIKSEERIMINE
Rakke kogudes toimi järgnevalt:
- Enne materjali koguma asumist tuleb suud loputada korralikult viis korda kraaniveega, et suu saaks võimalikult puhtaks;
- eelnevalt tuleb kraaniveega niisutada ka tsütoharja;
- seejärel tõmmata põsk ühe käega hammastest eemale, teise käega viia tsütohari suhu põse limaskesta vastu ning teha harjaga kümme korda õrnu pöörlevaid kraapivaid liigutusi. Vältige harjaga hammaste vastu minemist, seeläbi tuleb kaasa vähem kõrvalist materjali ning lõpptulemus jääb puhtam ja kvaliteetsem (joonis1);
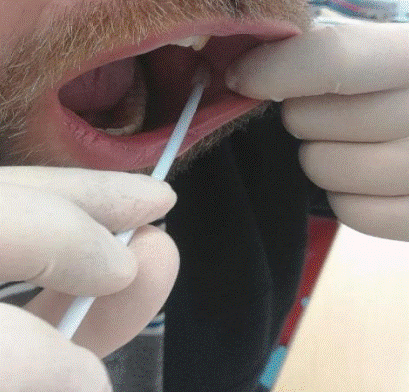
- Seejärel tuleb tsütoharjaga minna õrnalt vastu alusklaasi ning kergelt keerutades üle klaasi, et rakud jääksid alusklaasile võimalikult laiali ega esineks tihedaid rakkude kogumikke (joonis 2);

- äiged fikseeritakse värvivannis 95% etanoolis 30 minutit;
- seejärel lastakse preparaatidel kuivada tõmbekapi all filterpaberil proovimaterjal pealpool õhuga kokkupuutes 15 minutit.
3.7.7 VÄRVIMISE KÄIK
Märgistada ja valada vannidesse kõik töölahused. Seejärel hoida preparaate lahustes vastavalt all olevale skeemile:
| Harris’e hematoksüliin | 2 min; |
| destilleeritud vesi (loputada | 3 min; |
| 70% etanool | 2 min; |
| 3% NH4OH 70% etanoolis | |
| 70% etanool | 2 min; |
| 80% etanool | 2 min; |
| 95% etanool | 2 min; |
| OG 6 värv — Papanicolaou oranž | 2 min; |
| 95% etanool | 2 min; |
| 95% etanool | 2 min; |
| EA 50 värv — Papanicolaou EA 50 | 2 min; |
| 95% etanool | 2 min; |
| 95% etanool | 2 min; |
| 95% etanool | 2 min; |
| isopropanool + ksüleen 1 ։ 1 vahekorras | 2 min; |
| ksüleen | 2 min; |
| ksüleen | 2 min või kuni võimalik sulundada. |
Preparaadid võtta ksüleenist välja ning kergelt kuivatada külgetelt ning tagumiselt poolelt. Seejärel panna preparaatidele parajas koguses histokit palsamit ning katta sobivas suuruses katteklaasiga. Vajadusel eemaldada mullid ning lasta kuivada.
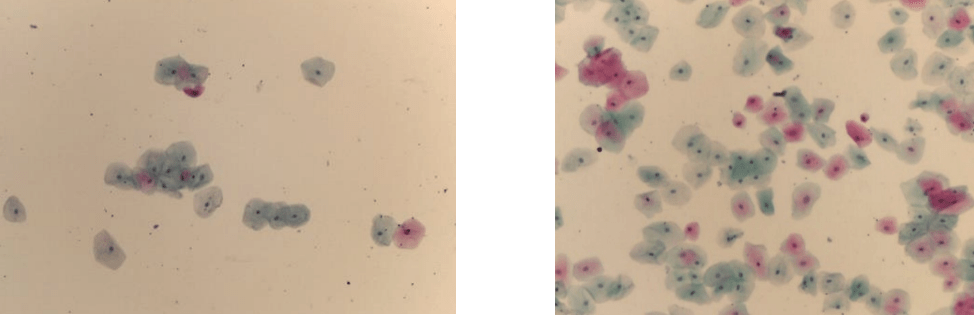
3.7.8 TULEMUSED JA HINDAMINE
Esmalt mikroskopeeritakse preparaati 10 × 10 suurendusega, seejärel hinnatakse rakke 10 × 40 suurendusega.
Rakutuumad värvuvad — siniseks
Tsütoplasma värvub — siniselt, rohekalt, roosalt sõltuvalt raku küpsemisastmest
Rakkudes olev keratiin värvub — oranžilt
Tuumad — tumesinised