| Tartu Tervishoiu Kõrgkool Bioanalüütika labori kvaliteedikäsiraamat | ||
| Koostas: | Elis Oja | Kuupäev 08.01.2018 |
| Kinnitas: | Mare Remm | Kuupäev 08.01.2018 |
3.4.1 MEETODI ULATUS
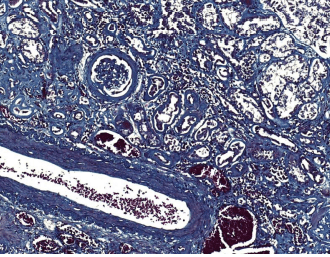
In Vitro: Masson trikroom värvingumeetod värvib tuumad siniseks kuni mustaks; tsütoplasma, lihased, erütrotsüüdid punaseks; kollageeni siniseks.
3.4.2 MEETODI KEHTIVUS
Meetod kehtib kasutamiseks õppetöös: JAH
Meetod kehtib kasutamiseks teadusuuringute teostamisel: JAH
Meetod kehtib kliiniliseks kasutamiseks patsiendi proovide teostamisel: EI
3.4.3 EESMÄRK
Juhend on välja töötatud Tartu Tervishoiu Kõrgkooli patoloogia labori tehnoloogia aine raames kasutamiseks histoloogiliste preparaatide värvimiseks Masson trikroom värvimis-meetodil. Meetod värvib rakutuumad sinisest kuni mustani, punasena lihaskiud ja erütrotsüüdid ning tumesinisena kollageenkiud.
Pärast juhendi läbitegemist oskab tudeng:
- tagada enda, kaastöötjate ja keskkonna ohutuse tööprotsessis;
- kasutada patoloogia labori töövahendeid ja valdab erialast terminoloogiat;
- valmistada vajalikke lahuseid;
- teostada histoloogilise preparaadi valmistamise etappe ja mõistab nende põhimõtet;
- järgida juhendit ja teostada värving edukalt;
- hinnata saadud preparaadi kvaliteeti.
3.4.4 TEGEVUSJUHIS
3.4.4.1 Proovimaterjali ettevalmistus
Pärast koetüki väljalõikamist materjal töödeldakse koeprotsessoris: fikseeritakse 10% puhverdatud formaliiniga, seejärel vabastatakse fiksaatorist ja veetustatakse. Fiksaatorist vabastamine ja veetustamine on vajalikud järgnevate ainete tungimiseks koetükki. Parafiinsisestus toimub vastavalt üldistele nõuetele. Värvingu jaoks on vajalikud õhukesed koelõigud paksusega 3 µm. Lõigud sirutatakse vesivannil, püütakse alusklaasile ja hoitakse kinnitumiseks vähemalt 40 min soojal laual või termostaadis (56 °C juures).
3.4.4.2 Töövahendid
Värvinguprotsessiks vajalikud vahendid: viis 100 ml Erlenmeyer’i kolbi, kaal, spaatlid, 1 ml klaaspipett, kummipirn, mõõtesilinder, klaaspulk, stopper, 100 ml värvivannid, kleepsud anumate märgistamiseks, kirjutusvahend.
3.4.4.3 Ohutusnõuded ja jäätmekäitlus
Kogu tööprotsessi jooksul kanda kindaid ning laborikitlit. Vältida kemikaalide sattumist nahale ja limaskestadele (tabel 1). Töötada tõmbekapi all, vältida kemikaali aurude sissehingamist. Kasutatud värvilahused ja reagendid koguda vastava märgistusega jäätmenõudesse, millel on vastava kemikaali nimetus. Lahuseid ei tohi valada kanalisatsiooni, need saadetakse hiljem jäätmekäitlusesse.
| Pulbriline hematoksüliin, C16H14O6 |  |
| Raud(III)Kloriid, FeCl3 |   |
| Happeline fuksiin, C20H17N3Na2O9S3 |   |
| Xylidine ponceau, C18H14N2Na2O7S2 |   |
| Fosfomolübdeenhape, H3PMo12O40 |    |
| Metüleensinine, C16H18ClN3S |   |
| Jää-äädikhape (kontsentreeritud etaanhape), CH3CO2H |   |
| Etanool, C2H6O |    |
Tabel 1. Vajalikud reagendid ja nendega seotud ohud
3.4.5 TÖÖLAHUSTE VALMISTAMINE
3.4.5.1 Ettevalmistus
Võtta 6 Erlenmeyeri koonilist kolbi, märgistada need kleepsude abil valmistatavate lahuste nimetustega. Nimetused kleepida ka värvivannidele.
3.4.5.2 Weigerti töölahus — koosneb kahest lahusest
Lahus A — kaaluda 100 ml Erlenmeyer’i kolbi 0,5 g pulbrilist hematoksüliini. Mõõtesilindriga mõõta 50 ml 95% etanooli ja valada hematoksüliinile. Kiiremaks lahustamiseks võib lahust soojendada, segada klaaspulgaga.
Lahus B — kaaluda 100 ml Erlenmeyer’i kolbi 0,58 g raud(III)kloriidi (FeCl3)*. Lisada mõõtesilindriga mõõdetud 49 ml destilleeritud vett. Klaaspipeti ja kummipirni abil lisada 0,5 ml jää-äädikhapet.
* Tegu on puhta aine kaaluga, kristallveesisaldusega aine puhul teha vajalikud ümberarvutused nii aine kui ka lisatava vee koguse osas.
Töölahuse saamiseks segada kokku vahetult enne kasutamist lahused A ja B võrdsetes kogustes.
3.4.5.3 Happelise fuksiini lahus
Kaaluda 100 ml Erlenmeyer’i kolbi 0,5 g happelist fuksiini ja 0,5 g xylidine ponceau’d (C18H14N2Na2O7S2). Lisada mõõtesilindriga mõõdetud 98 ml destilleeritud vett. Lisada klaaspipetiga 1 ml jää-äädikhapet.
3.4.5.4 Fosfomolübdeenhappe 1 % lahus
Kaaluda 100 ml Erlenmeyer’i kolbi 1 g fosfomolübdeenhapet (H3PMo12O40). Lisada sellele mõõtesilindriga mõõdetud 99 ml destilleeritud vett. Lahustada aine kolbi ringjalt liigutades.
3.4.5.5 Metüleensinise lahus
Mõõtesilindriga mõõta 33 ml metüleensinist 100 ml Erlenmeyer’i kolbi. Lisada 66 ml destilleeritud vett.
3.4.6 VÄRVIMISE KÄIK
3.4.6.1 Värvivannide ettevalmistus
Märgistada ja valada vannidesse: parafiini lahustamise rida, vette viimise rida, töölahused: Weigert’i töölahus (sildistada vann, kuid töölahus valada kokku alles vahetult enne kasutamist), happelise fuksiini värvilahus, fosfomolübdeeni lahus, metüleensinise värvilahus ja loputamisnõud, lõpliku veetustamise ja selgitamise rida ning katmisvahendid.
3.4.6.2 Värvimine
Viia läbi värvimine vastavalt all olevale skeemile.
- Lahustada parafiin: 1. ksüleen (5min) → 2. ksüleen (5min) → 3. ksüleen (5min).
- Teostada vette viimine: 95% etanool (3 min) → 95% etanool (3 min) → 60% etanool (3 min) → destilleeritud vesi (3 min).
- Segada Weigert’i töölahuse saamiseks kokku lahused A ja B suhtes 1 : 1.
- Hoida Weigert’i töölahuses prepraate 10 minutit.
- Loputada läbi kahe destilleeritud vee.
- Hoida preparaate happelise fuksiini värvilahuses 15 minutit.
- Loputada läbi 3 destilleeritud vee (vajadusel rohkem), kuni vesi jääb puhtaks.
- Diferentseerida 1% fosfomolübdeenhappe lahuses 3 minutit.
- Loputada destilleeritud vees.
- Värvida metüleensinise lahuses 10 sekundit.
- Loputada destilleeritud vees
- Veetustada: 95% etanool (3 s) → 95% etanool (3 s) → isopropanool (3 s)
- Selgitada: ksüleen (3min) → ksüleen (3min) → ksüleen (2 min või kuni katmiseni).
- Kanda preparaadile kattepalsam ning katta sobiva suurusega katteklaasiga. Eemaldada vajadusel mullid ja puhastada preparaat. Etikettida.
3.4.7 TULEMUS
Erütrotsüüdid ja lihaskiud — tumepunased
Kollageen ja luukude — sinised
Tuumad — tumehallid