Saateks
Günekotsütoloogilise materjali hindamine on vastutusrikas, kuid teataval määral subjektiivne analüüs, kuna nähtavate rakumuutuste interpretatsioon on mõjutatud hulgaliselt erinevatest ekso- ja endogeensetest teguritest. Günekotsütoloogiliste proovide vastuste kvaliteet sõltub personali väljaõppest ja laboris toimivast kvaliteedisüsteemist. Käesolev õppematerjal on mõeldud bioanalüütiku õppekava üliõpilaste koolitamisel ja tsütoloogia laboris tööd alustavatele bioanalüütikutele. Teatmik sisaldab emakakaela materjalis esinevate erinevate rakkude kirjeldusi (norm, reaktiivsed muutused ja atüüpilised muutused) ja konventsionaalsel Papanicolaou meetodil valmistatud günekotsütoloogiliste äiete hindamist vastavalt Bethesda süsteemile. Õppematerjal käsitleb ka erinevaid infektsioonitekitajaid, kes võivad esineda günekotsütoloogilistes äietes. Kuigi günekotsütoloogilise materjali hindamine moodustab ainult ühe osa tsütoloogia labori tööst, tegelevad selle esmalthindamisega just bioanalüütikud.
Teavik on varustatud rohke pildimaterjaliga erinevatest emakakaela patoloogilistest seisunditest, mis on diagnoositud Ida-Viru Keskhaiglas, SA TÜK Kliinikumi Patoloogiateenistuses ja SYNLAB Eesti OÜ tsütoloogia laboris. Kõikide jooniste, millel ei ole viidet, autoriteks on väljaande autorid.
Autorite tänu nendele, kes on meid kirjutamisel abistanud. Käsikirja valmimisele on kaasa aidanud ja täiendusi ning parandusi teinud Vladimir Jermoljuk, Kristina Kööts, Mai Treial, Jane Remm ja Liina Remm.
/Hilisemalt on kogu töö originaalteksti muutnud Hannaliis Ansip./
3.1.1. ÜLEVAADE GÜNEKOTSÜTOLOOGILISE UURINGUMATERJALI VÕTMISE PIIRKONNAST JA KOMPONENTIDEST
3.1.1.1. Günekotsütoloogiline materjal
Emakas ehk uterus on pirnikujuline umbes kaheksa sentimeetri pikkune organ, mis jaguneb kolmeks osaks (joon 1):
- emakakeha (corpus uteri);
- emakakitsus (isthmus uteri);
- emakakael (cervix uteri).
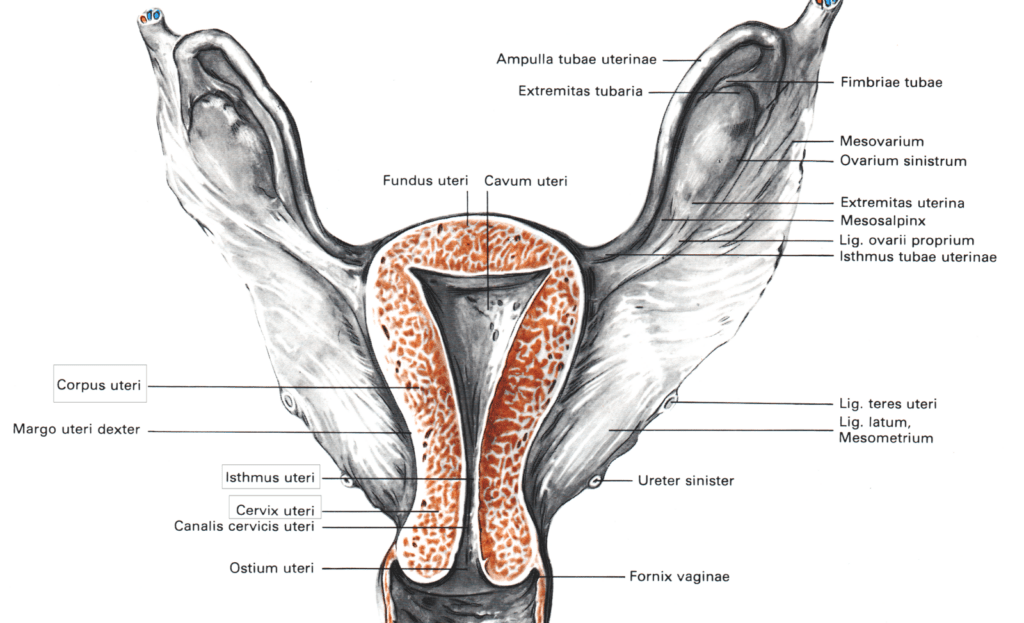
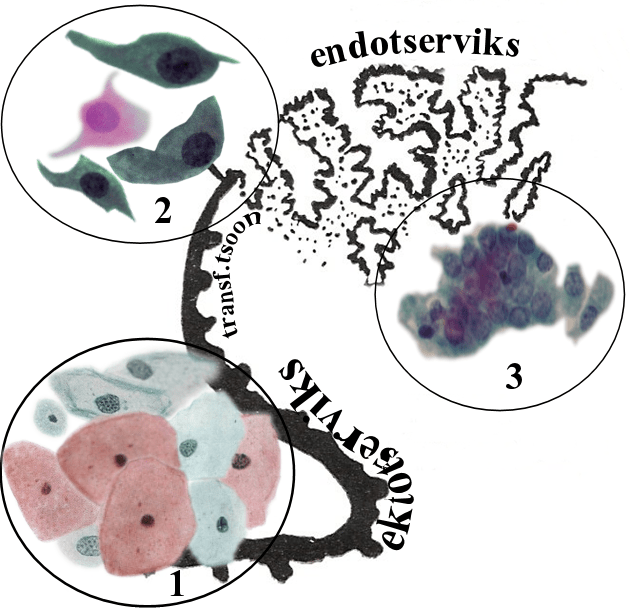
Käesolev õppematerjal keskendub just emakakaelale. Tegemist on emakakitsuse jätkuga, mis jaguneb kolmeks osaks: ektotserviksiks, endotserviksiks ja transformatsioonitsooniks, mis olenevalt vanusest ja menstruaalstaatusest, paikneb kas rohkem endo- või ektotserviksi suunas.
Emakakaelal on tavapäraselt kolme tüüpi epiteeli (joon 2):
- sarvestumata mitmekihiline lameepiteel, mis katab tuppe ja emakakaela tupepoolset osa ehk ektotserviksit;
- ülemineku- ehk metaplastiline epiteel, mis katab transformatsioonitsooni;
- silinder- ehk näärmeepiteel, mis vooderdab emakakaelakanalit ehk endotserviksit.
Günekotsütoloogilist preparaati vaadeldes me ei näe kude läbilõikes, vaid näeme ainult rakke, mis on äigesse sattunud, ehk neid, mis on materjali võtmise ajal koe pinnalt eemaldatud. Seetõttu on pilt hoopis erinev histoloogilisest pildist.
Bioanalüütik peab tundma Bethesda süsteemi, mis Eestis rakendus 2001. aastal. Bethesda süsteem on rakendatav kõikide tsütoloogiliste uuringute puhul, nende seas ka günekotsütoloogiliste uuringute hindamiseks. Esiteks peab bioanalüütik vastu võtma otsuse, kas proov on piisav, et seda hinnata, ehk tunnistama selle adekvaatseks, või jääb proov hindamiseks mitterahuldavaks. Seejärel peab bioanalüütik olema võimeline eristama viit emakakaela rakkude hindamise kriteeriumit Bethesda süsteemi järgi:
- normipärane leid (NILM);
- reaktiivsed rakulised muutused ja piiripealsed muutused, kus atüüpia genees on määramata (ASC-US, ASC-H, AGC-NOS);
- nõrga ja tugeva astme rakusisene düsplaasia (LSIL, HSIL, AGC-FN);
- Adenocarcinoma in situ (AIS);
- invasiivse vähi tunnused ehk tugev düsplaasia (HSIL) tõenäoliselt invasiivse iseloomuga (Solomon ja Nayar 2004).
Bethesda süsteem on levinud ja tuntud üle maailma, selle kohta on avaldatud mitmeid artikleid ja raamatuid. Siinkohal vaid üks viide: Bethesda süsteemi atlase lingile ― (Bethesda system website atlas) http://nih.techriver.net/
3.1.1.2. Günekotsütoloogilise äigematerjali komponendid
Korrektselt kogutud günekotsütoloogiline äie (PAP-test) võib sisaldada endas:
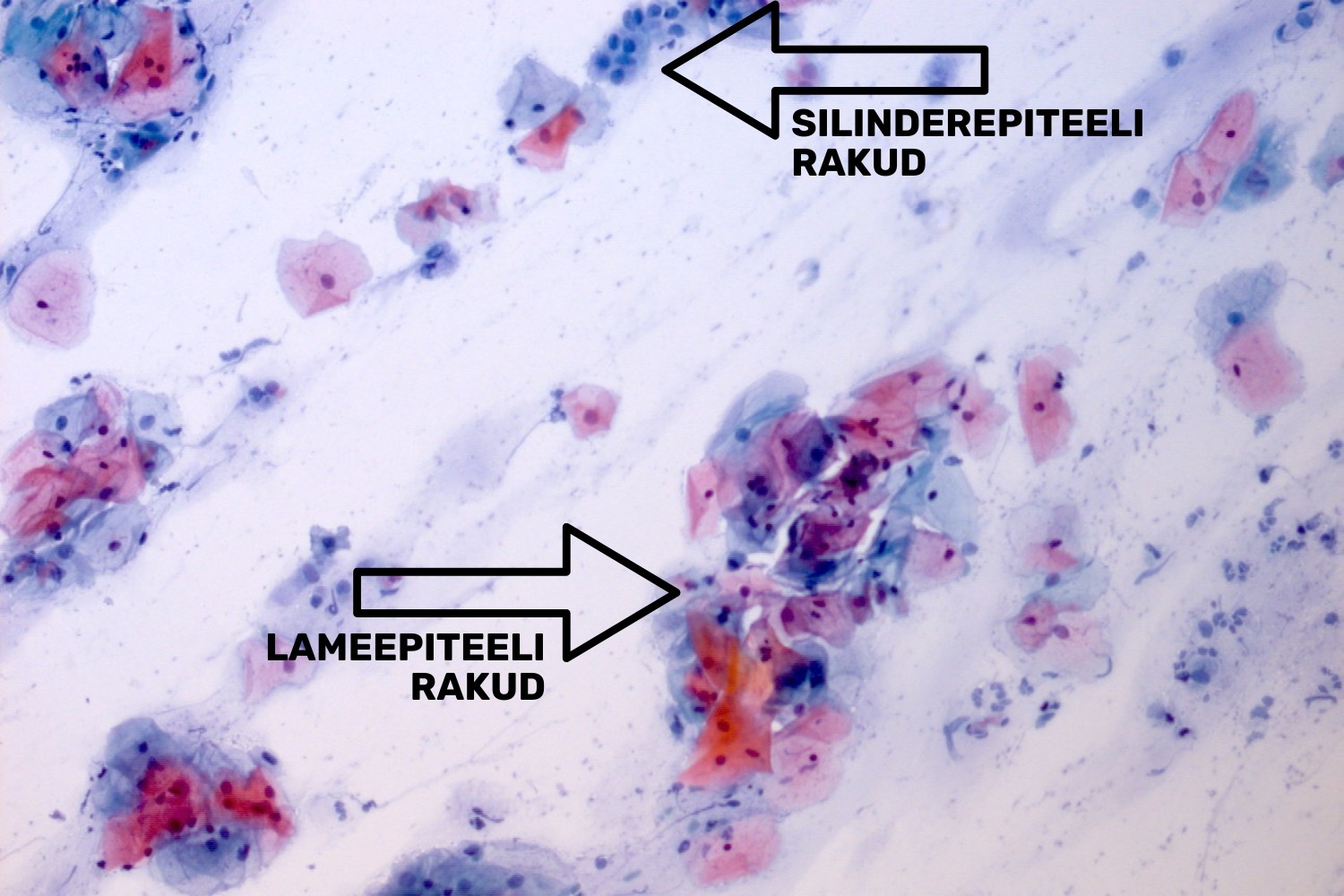
- lameepiteeli rakke (joon 3);
- silinderepiteeli rakke (joon 3);
- metaplastilisi rakke;
- mõnel juhul endomeetriumi rakke;
- histiotsüüte, leukotsüüte, erütrotsüüte;
- normaalset vaginaalfloorat, põletikutekitajaid;
- mõnel juhul ka spermatosoide – sellisel juhul on tegemist võõrmaterjaliga ja mikrofloorat määrata ei saa
- lima või teisi artefakte, nt kinnaste talgi kristalle (Coleman jt 2005)
3.1.2. LAMEEPITEEL
3.1.2.1. Normipärane lameepiteel
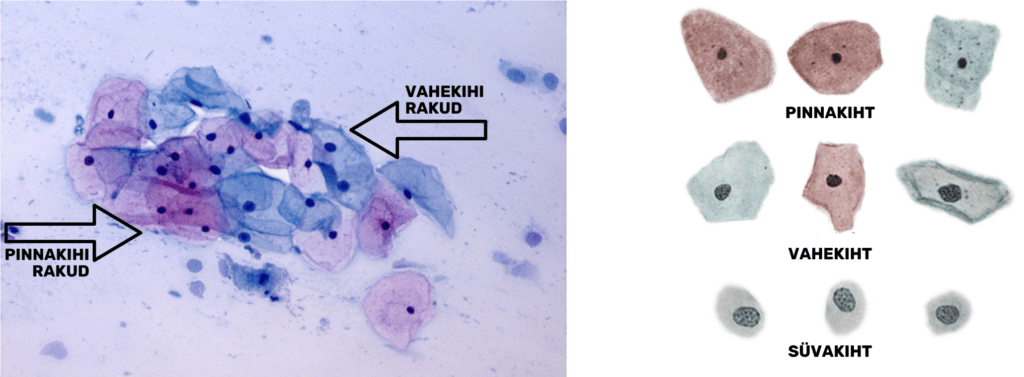
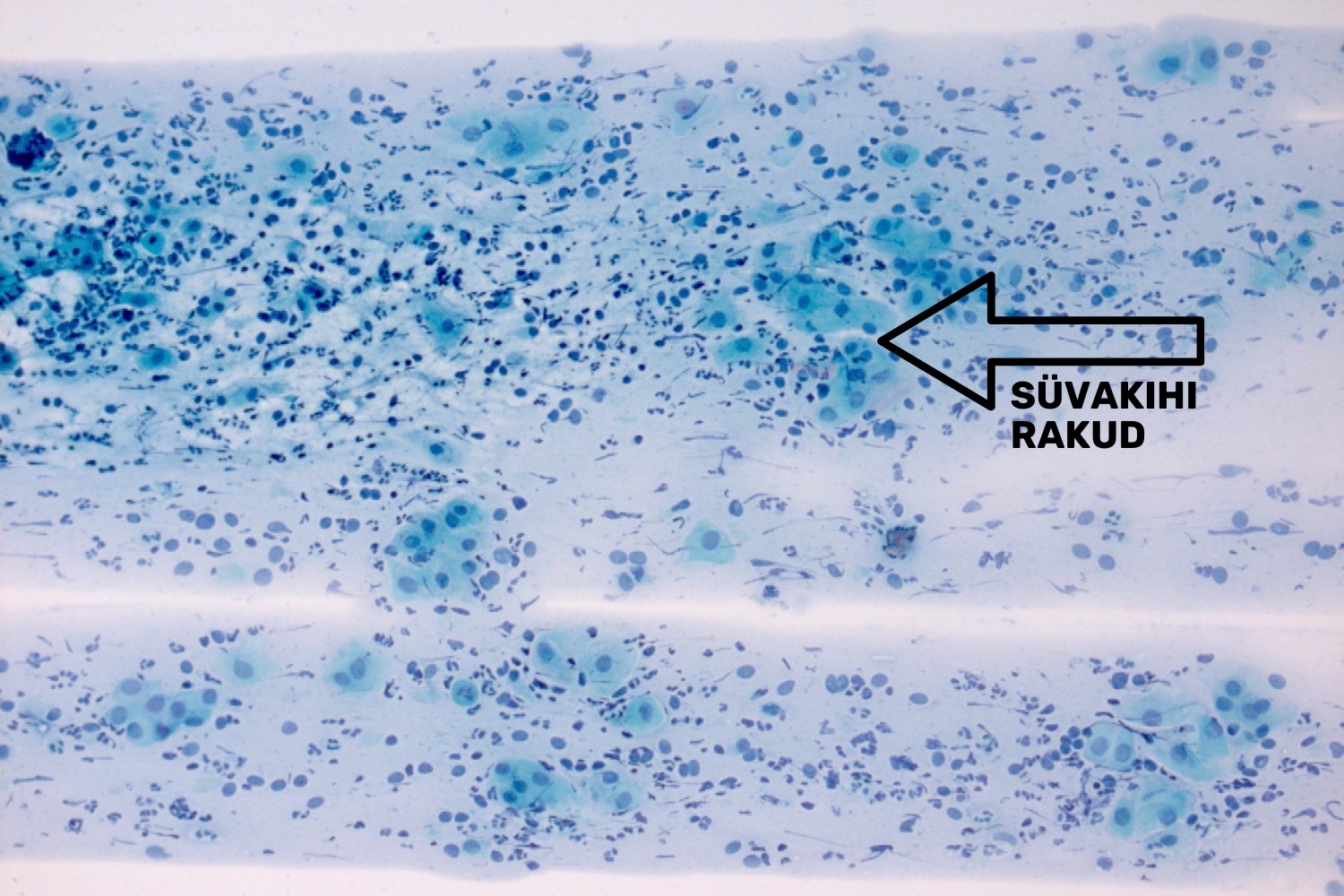
Mitmekihiline lameepiteel koosneb kolmest erinevast rakkude kihist: pindmise kihi, vahekihi ning süvakihi rakkudest, neist viimane sisaldab parabasaal- ja basaalkihi rakke (joon 4). Erinevate kihtide olemasolu preparaadis sõltub naise östrogeenide tasemest.
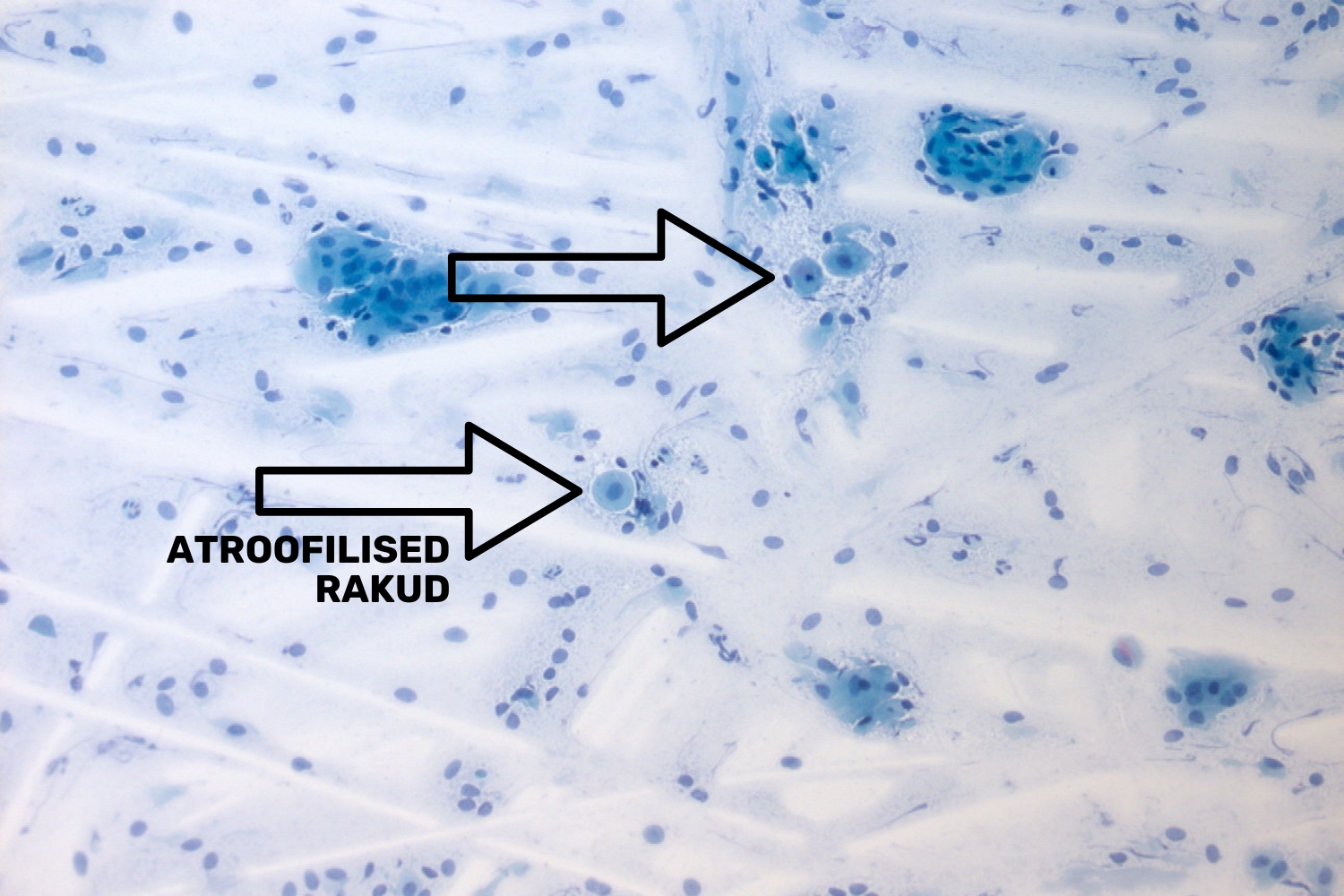
Postmenopausi perioodis naise günekotsütoloogilises äiges esinevad peamiselt vahe- ja süvakihi rakud, kuid võib välja kujuneda ka atroofia (joon 5), millele võivad lisanduda ka reaktiivsed muutused ja leukotsüütide esinemine, sellisel juhul on tegemist atroofilise vaginiidiga.
Emakakaela limaskesta transformatsioonitsoonis, kus kohtuvad lame- ja silinderepiteel, esineb vahevormina omapärase kujuga metaplastiline epiteel; tegemist on noore, väljakujunemata epiteeliga, mis hiljem küpseb lameepiteeliks (joon 6).
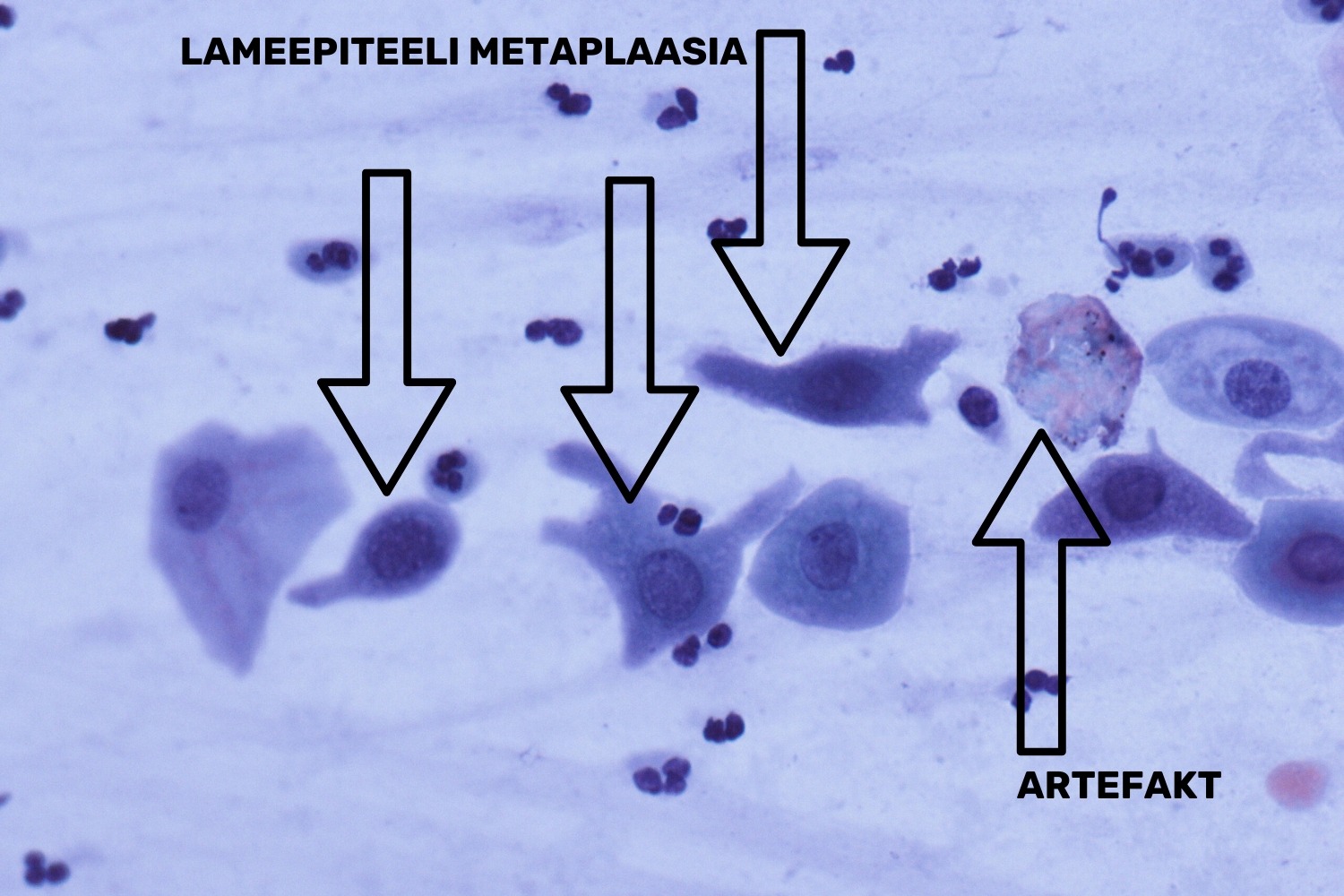
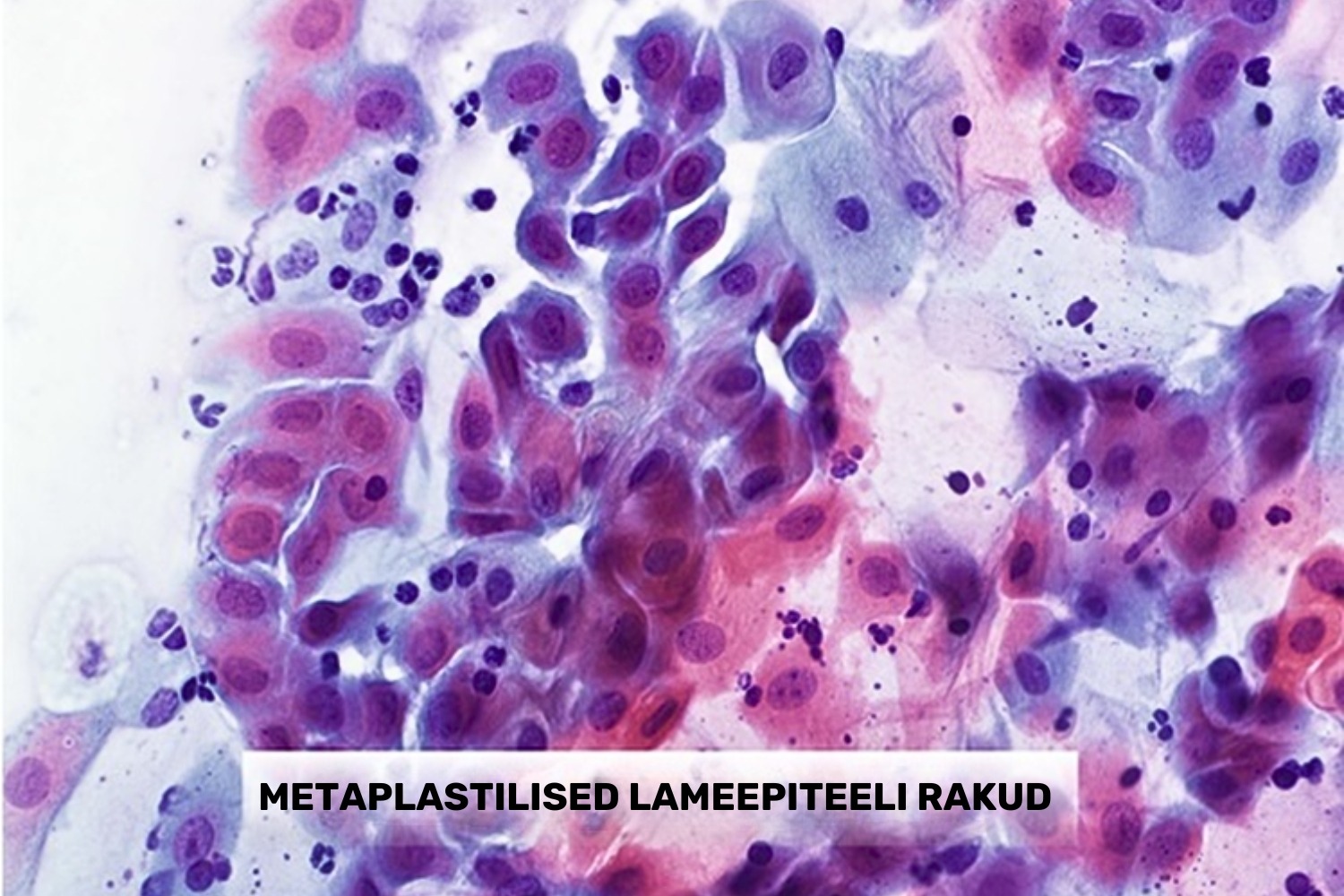
Metaplastilised rakud on väikesed ovaalsed või polügonaalsed lameepiteeli rakud (joon 7). Nende rakkude tuumad on ümmargused, kromatiin on peenikeste graanulitena ühtlaselt paigutatud ning tihti esineb tuumas väike tuumake. Metaplastilise raku tuum on veidi suurem kui vahekihi raku tuum, seega tuuma/tsütoplasma suhe on pisut tõusnud (Solomon ja Nayar 2004).
3.1.2.2. Lameepiteeli reaktiivsed muutused
Lameepiteeli reaktiivsust põhjustavad keemilised ained, füüsikalised tegurid ja erinevad mikroorganismid: viirused, seened, bakterid ja parasiidid. Infektsiooni tagajärjel tekib põletik, millega kaasnevad muutused äige pildis. Põletiku puhul esineb materjalis rohkesti neutrofiile. Lameepiteeli reaktiivsuse tunnused:
- tuuma muutused:
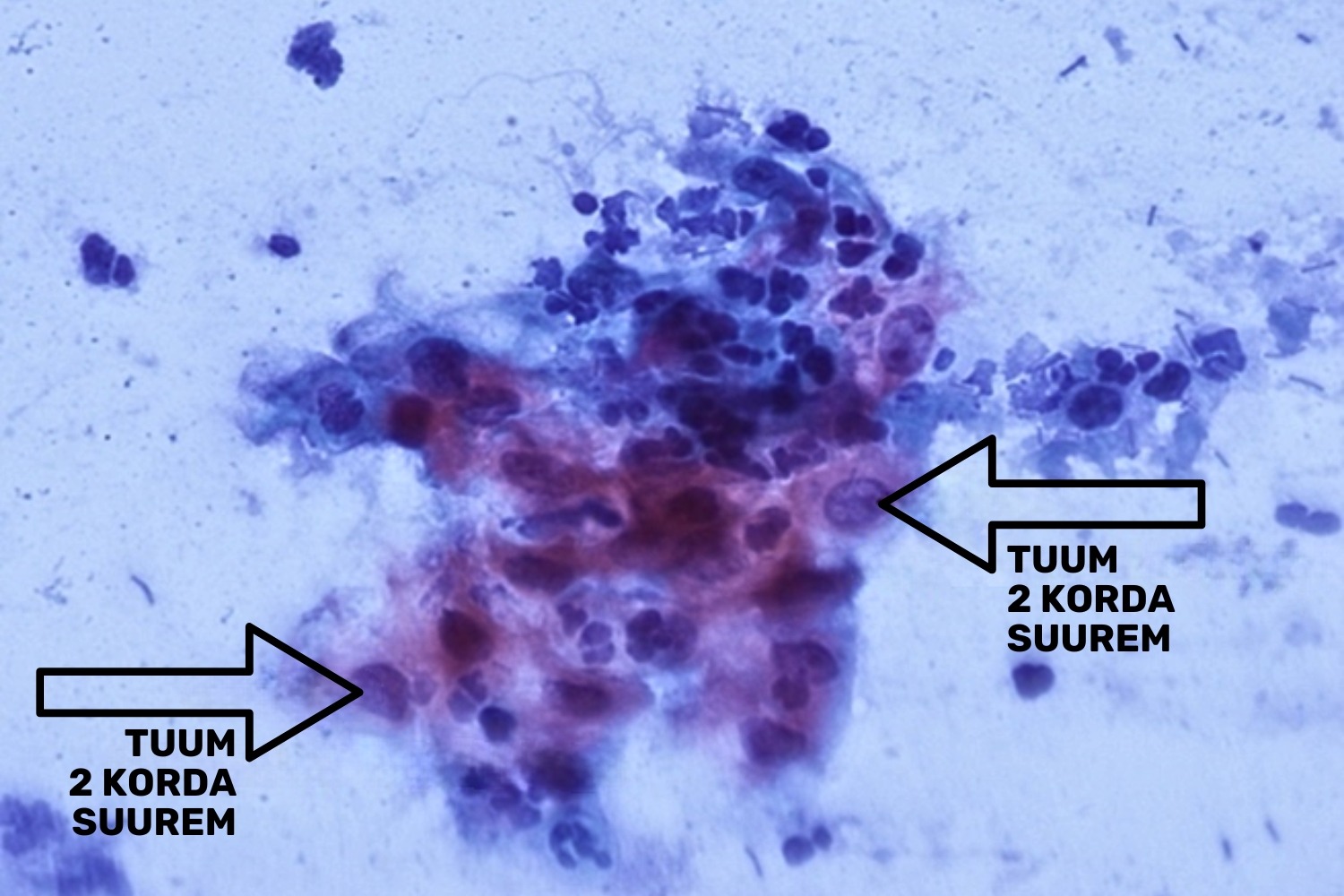
- tuum suureneb 2−3 korda, tuuma/tsütoplasma suhe (N/C ratio) ei muutu (joon 8);
- esineb tuumake;
- võib esineda kahe- või mitmetuumsus (bi- või multinukleaarsus);
- tsütoplasma muutused:
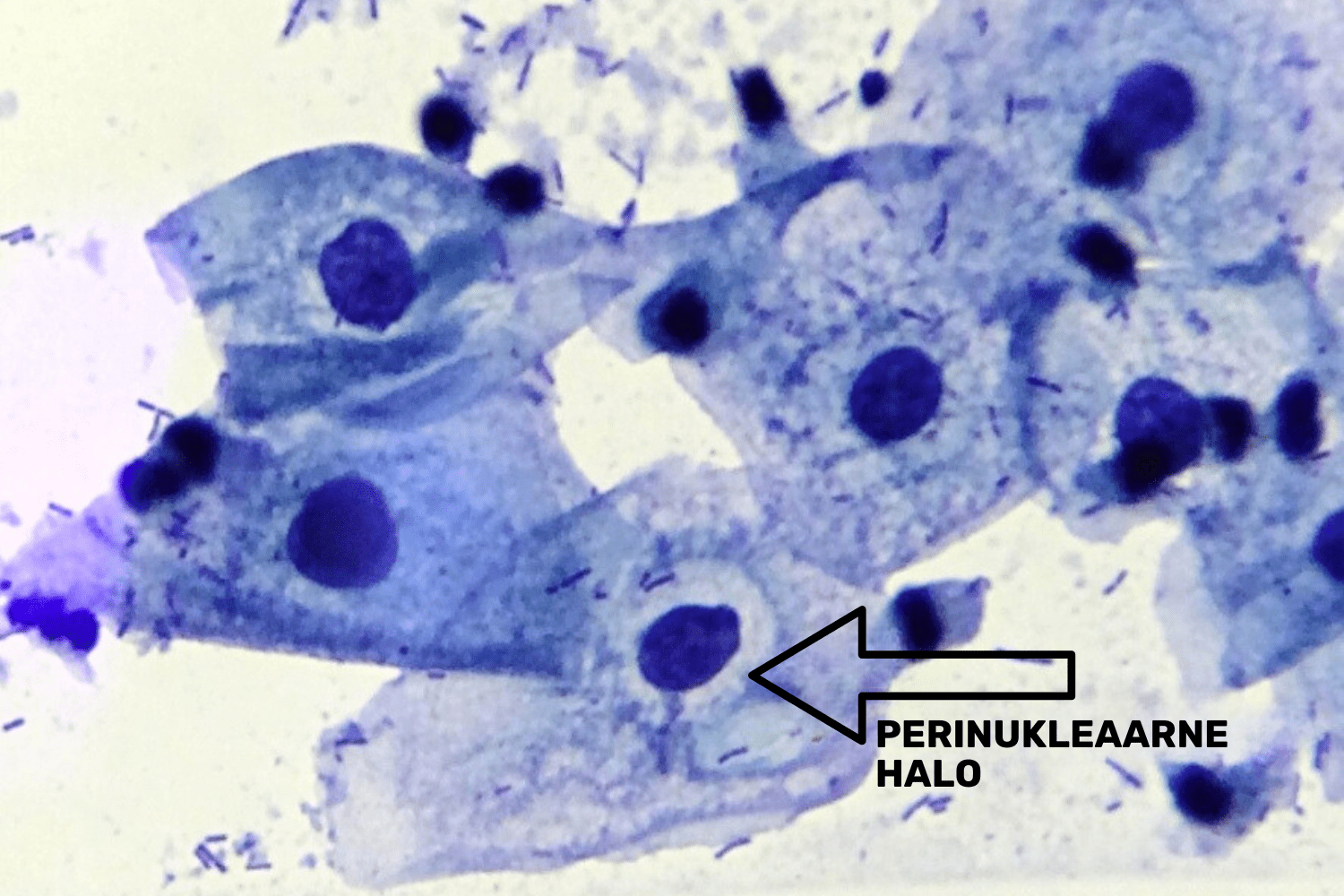
- esineb kitsas korrapärane halo tuuma ümber, mida nimetatakse perinukleaarseks haloks (mitte segi ajada koilotsüüdi haloga, mis on ebakorrapärane ja lai) (joon 9);
- tsütoplasma võib värvuda eri värviliselt, seda omadust nimetatakse amfifiilsuseks;
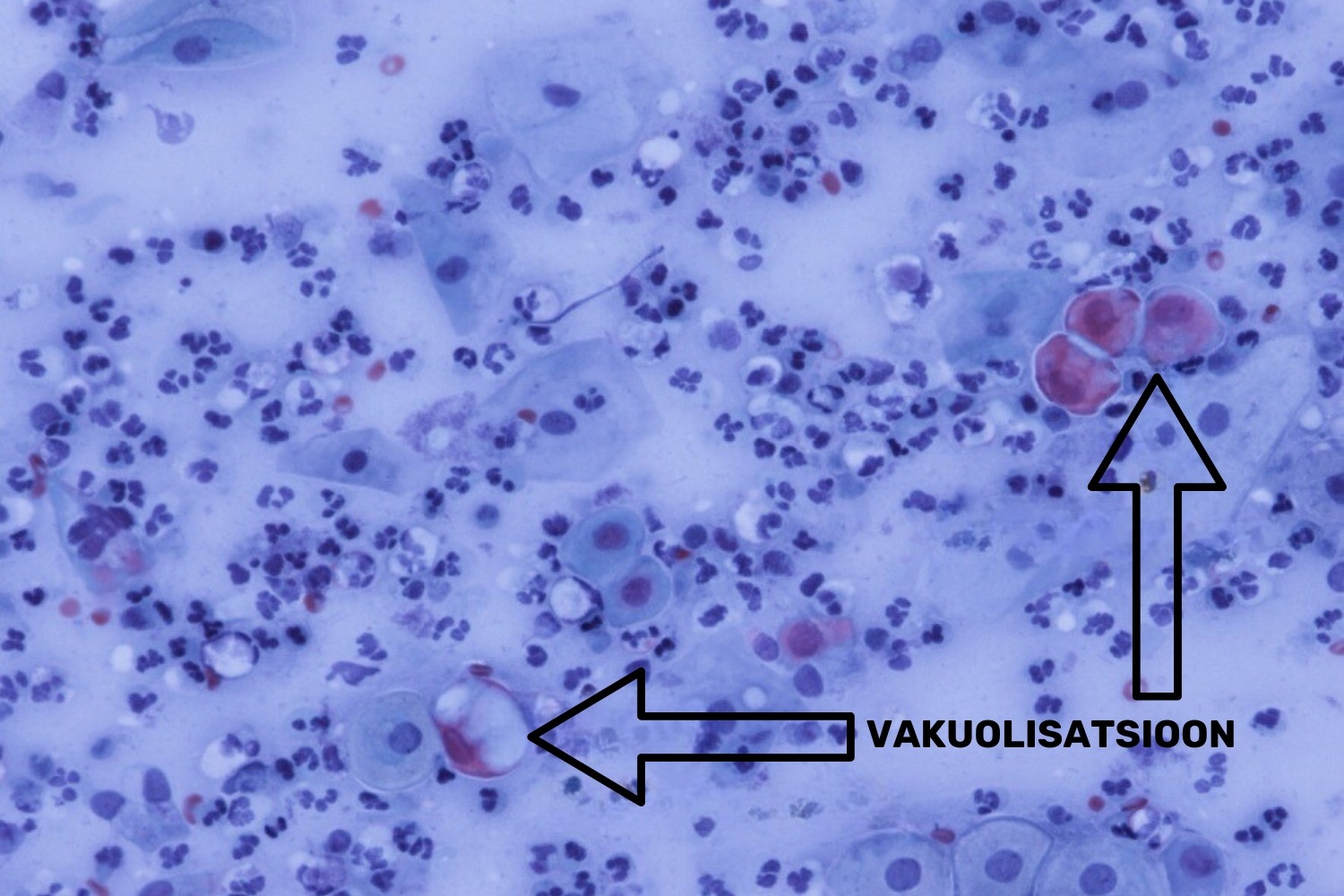
- võib esineda vakuolisatsioon;
- esineb hüper- ja parakeratoos (rakud värvuvad oranžiks) (joon 10).
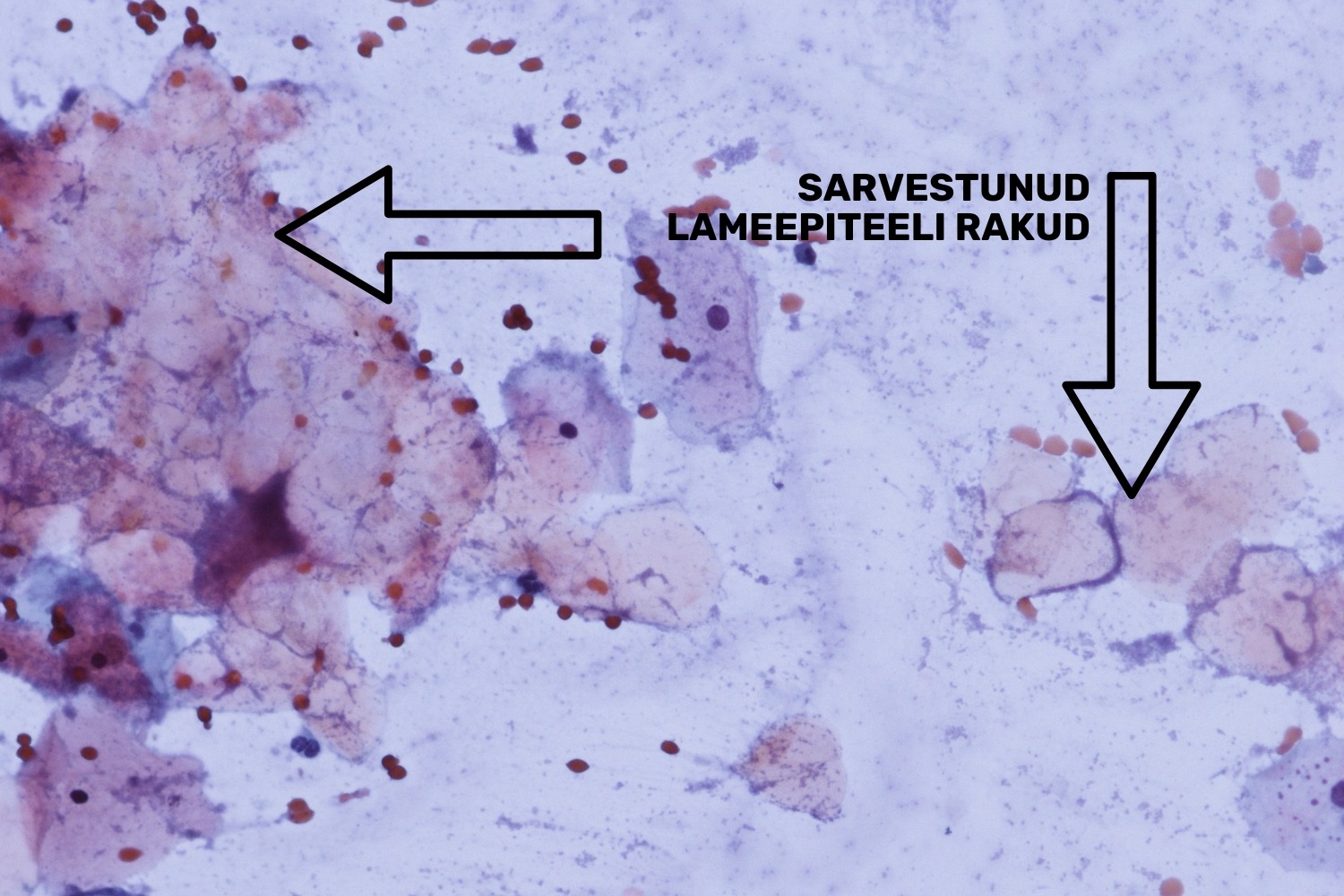
Hüperkeratootilised rakud ehk sarvliistakud on sarvestunud lameepiteeli rakud. Tavaliselt ektotserviksi epiteel ei sarvestu, ent põletiku puhul võib näha pindmise kihi lameepiteeli rakke, mis värvuvad oranžiks ja mille tuum on kadunud ning jäänud on vaid tuumavarjud (joon 11). Hüperkeratoos on healoomuline muutus, mida täheldatakse samuti leukoplaakia (leukoplakia) korral. Leukoplaakia puhul näeb günekoloog emakakaelal valget ala.
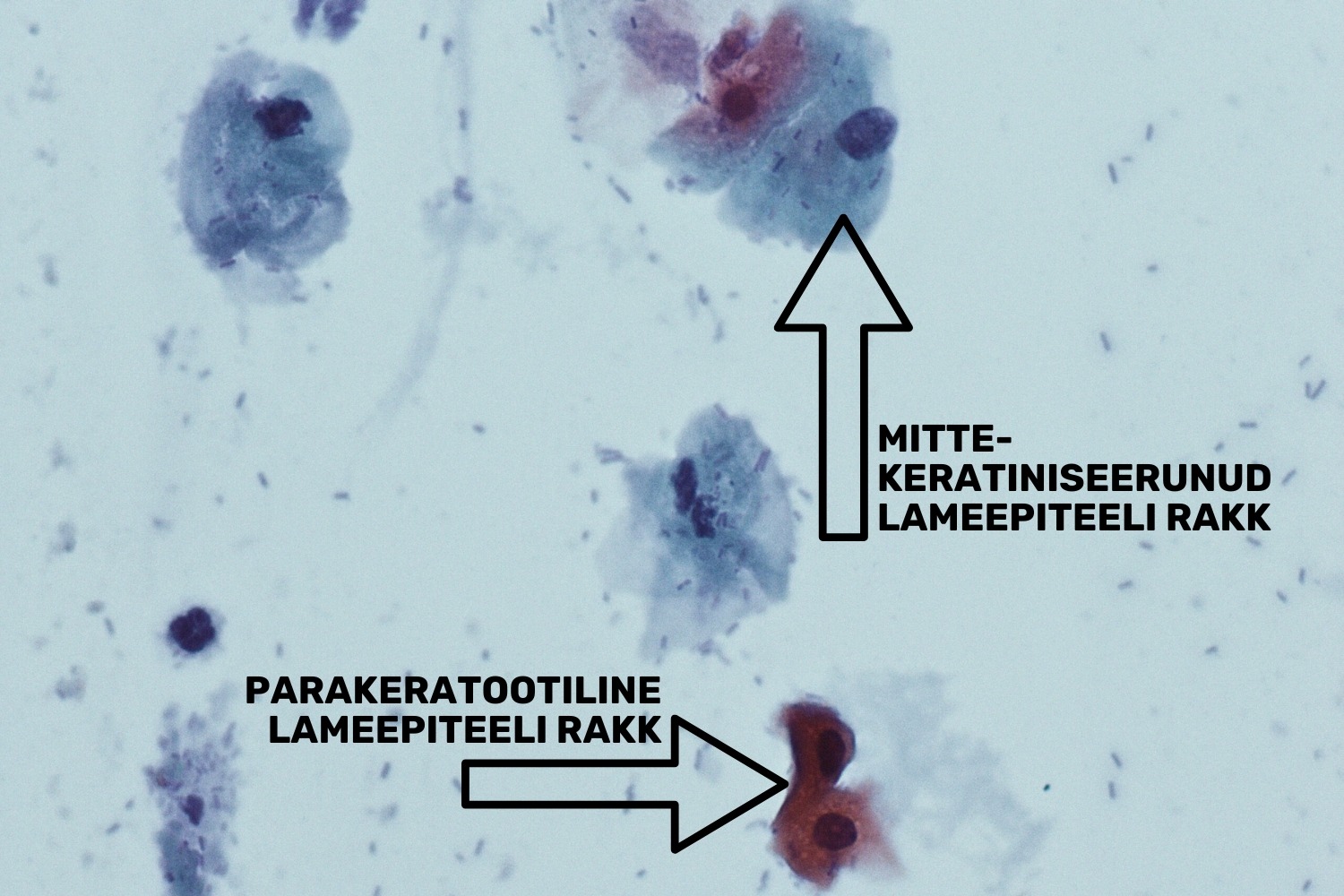
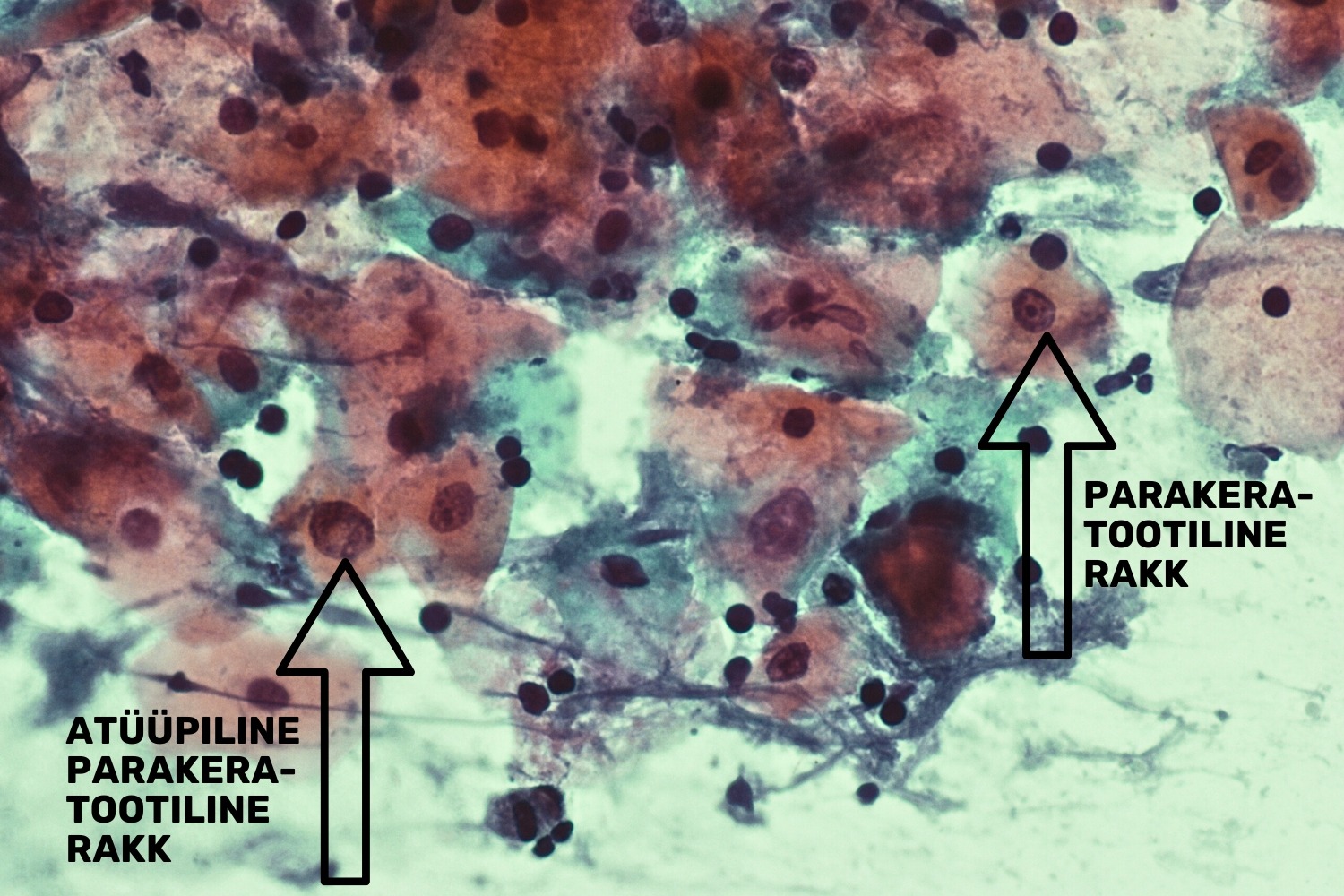
Sarnaselt hüperkeratoosiga võib esineda parakeratoos, mille iseloomulikuks tunnuseks on rakutuuma säilumine keratootilises rakus. Parakeratootilised rakud värvuvad tsütovärviga OG6, mis värvib rakkudes sisalduva keratiini oranžiks (joon 12). Pikaajaline krooniline põletik võib tekitada rakkude atüüpiat, mille korral me näeme atüüpilist reparatsiooni ja/või atüüpilist parakeratoosi (joon 13).
3.1.2.3. Põletikutekitajad günekotsütoloogilistes äietes
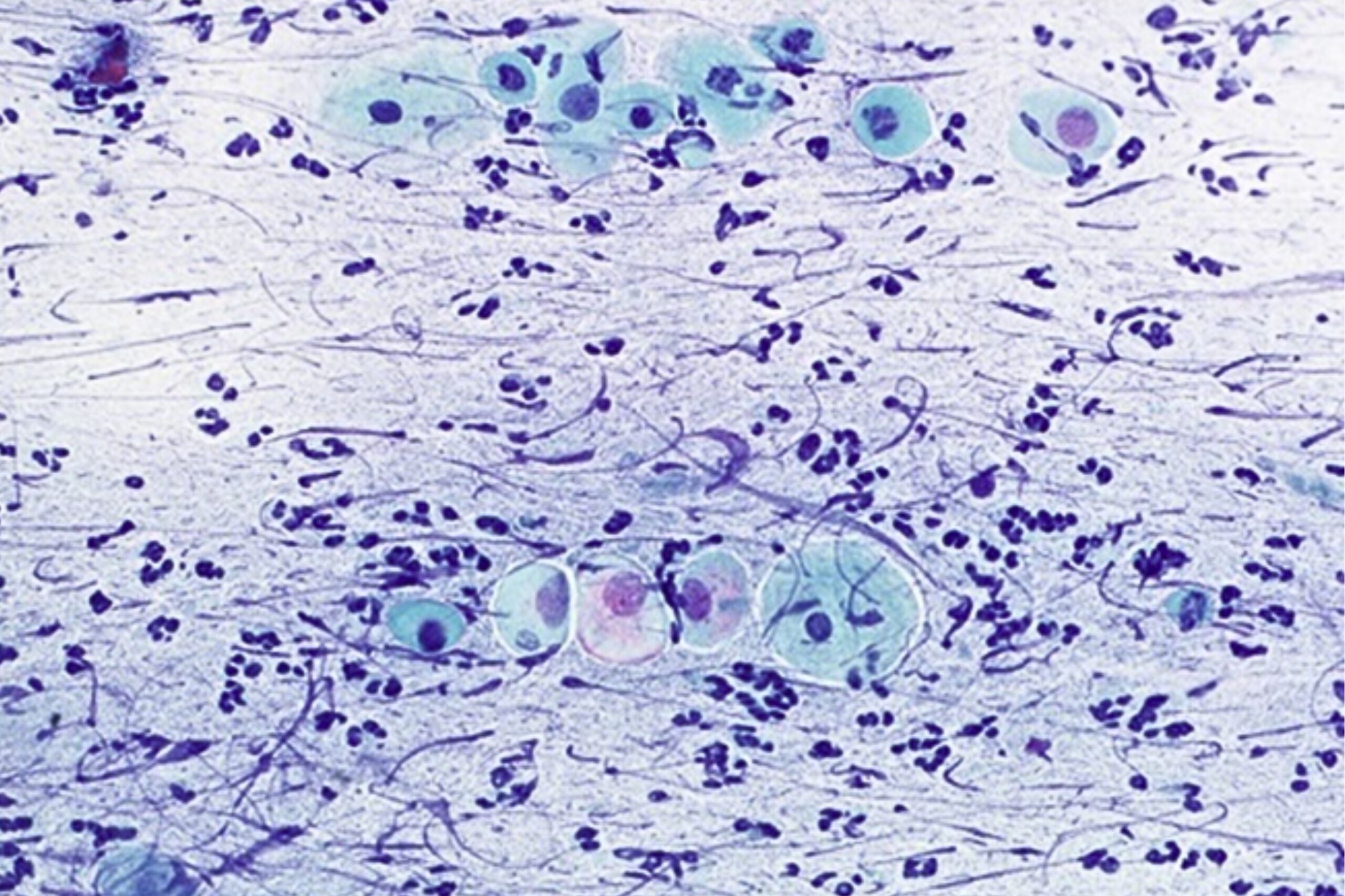
Emakakaela põletikud võivad olla spetsiifilised ja mittespetsiifilised. Mittespetsiifiline on näiteks bakteriaalne vaginoos (BV), millele on iseloomulik anaeroobse mikrofloora (Gardnerella vaginalis, Prevotella spp., Mycoplasma hominis, Mobiluncus spp.) domineerimine tupekeskkonnas. Selle tulemusena surutakse maha laktobatsillid ja pH muutub aluselisemaks. Spetsiifilise põletiku korral võib saada infektsioonitekitaja tuvastada tsütoloogilises preparaadis. Tupepõletiku ehk kolpiidi (vaginiidi) ja/või emakakaelapõletiku (tservitsiidi) tekitajaks võivad olla: Trichomonas vaginalis, Herpes simplex/genitalis, Candida spp, Actinomyces spp. Kõik nimetatud tekitajad võivad esile kutsuda emakakaela epiteeli reaktiivsuse, kuna põhjustavad ärritust ja põletikku. (Güdücü jt 2012)
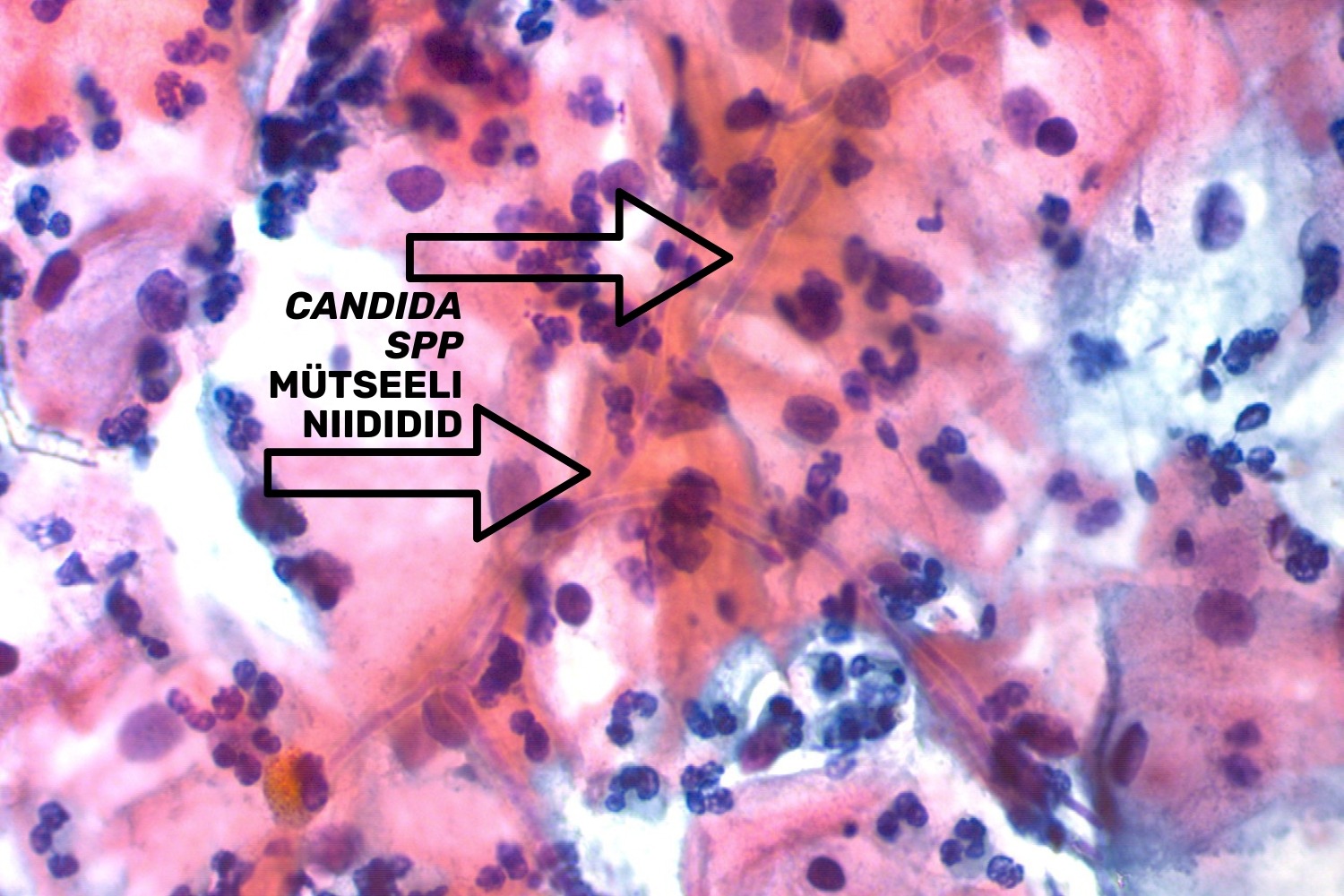
Emakakaela günekotsütoloogilistes äietes võib avastada seeninfektsiooni järgmiste tunnuste alusel ― hüüfide ehk mütseeliumi niitide ja/või eoste ja pärmi rakkude olemasolu. Hüüfide olemasolu korral kirjeldatakse neid vastuses kui seene mütseeli niidid, mis on iseloomulikud Candida spp-le (joon 14, 15, 16). Eoste olemasolul ja hüüfide puudumisel kirjeldatakse neid organisme kui pärmseeni, mitte kui Candida spp. (Donders 2007)
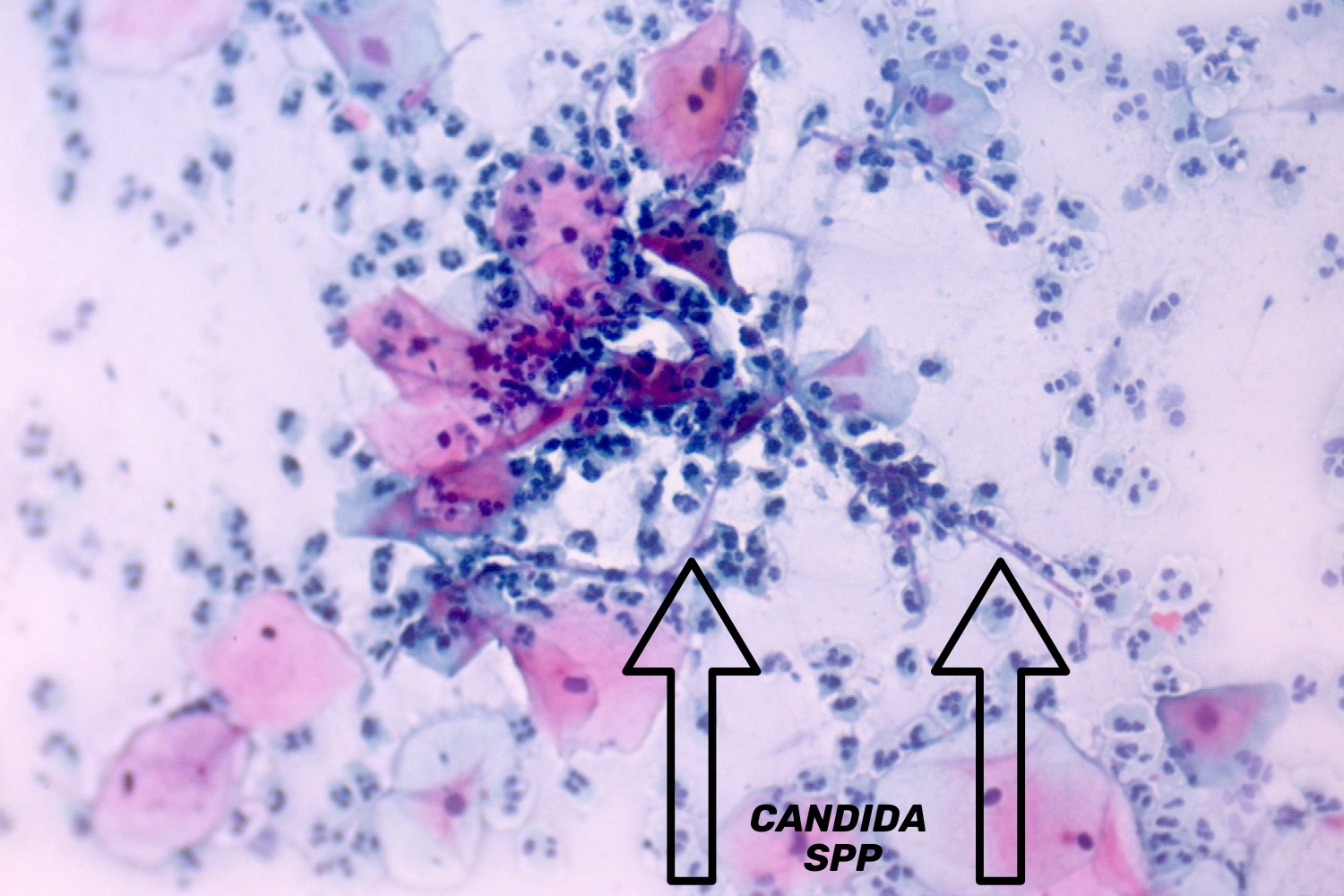
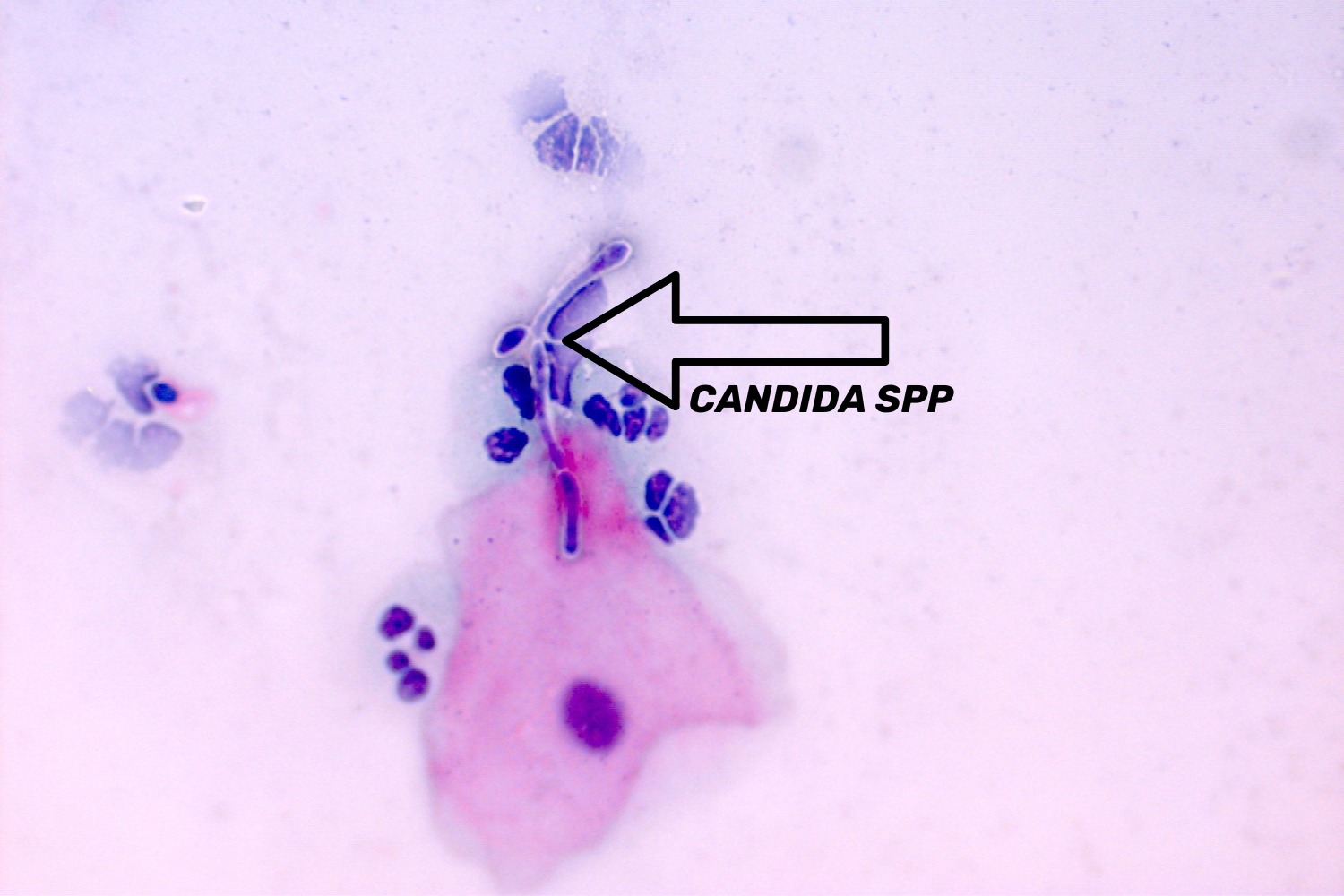
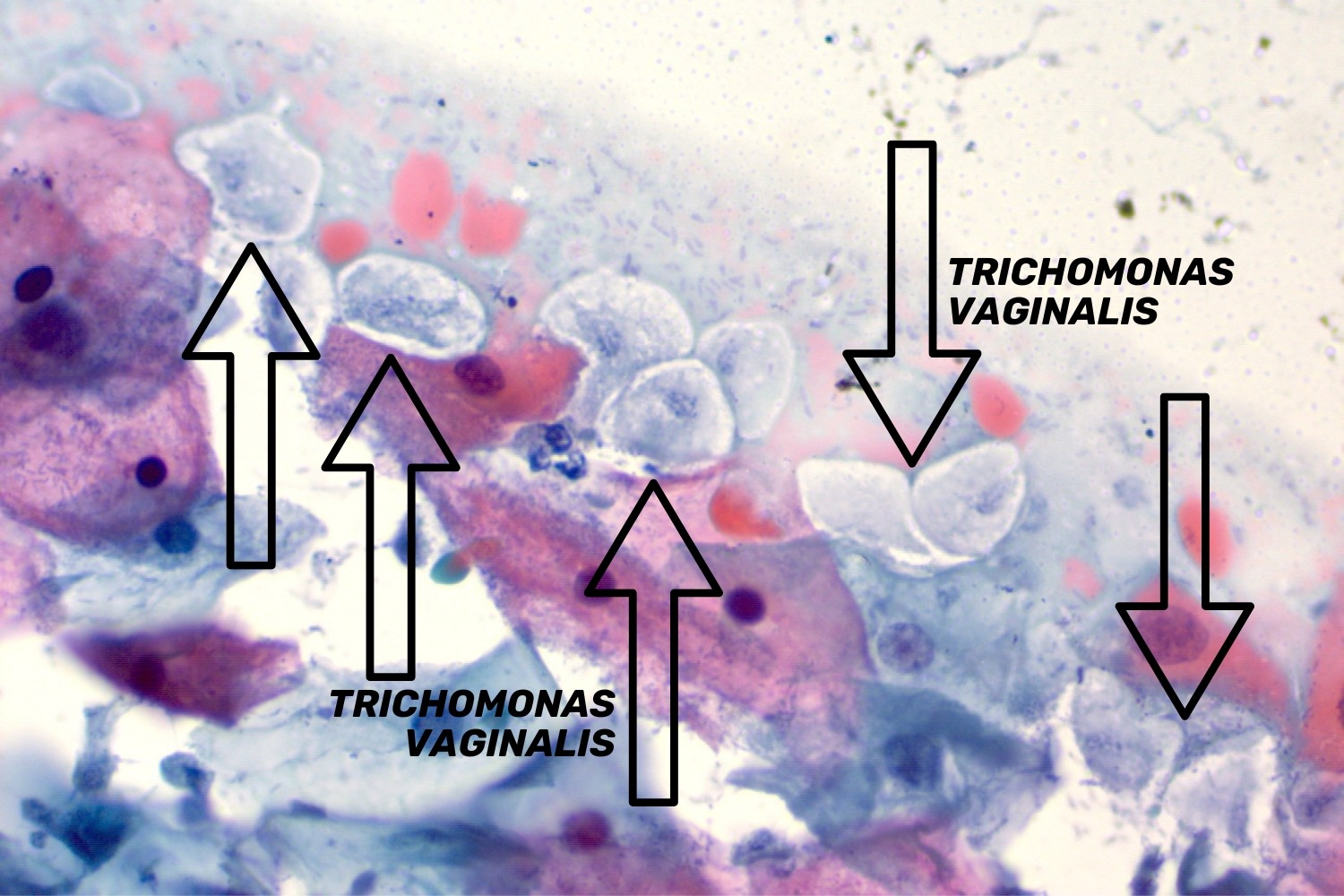
Vaginaalne trihhomoonas (Trichomonas vaginalis) on üherakuline parasiit. Trihhomoonased on sagedasti raskesti äratuntavad välise ilme järgi. Trihhomoonased võivad moodustada erinevaid vorme ning nende läbimõõt võib varieeruda 15−30 mikromeetrini. Neil on ovaalsed/pirnikujulised kehakesed, nende väike, ovaalne tuum asub tsütoplasmas ekstsentriliselt (joon 17). Papanicolaou värvingus värvub trihhomoonas õrnalt siniseks, tema tuum värvub samuti kahvatult, mis osaliselt raskendab tema diagnostikat eriti algaja mikroskopeerija puhul. Akuutse trihhomoniaasi korral on trihhomoonased väikesed ning pilt on tugevasti reaktiivne, tihti esineb lameepiteeli hüperkeratoosi ja rohkesti leukotsüüte. Kroonilise trihhomoniaasi puhul on trihhomoonased suuremad ja tsütoloogiline pilt ei ole reaktiivne ega esine palju leukotsüüte. (Bowden ja Garnett 2000)
Actinomyces perekonna liikide esindajad on Gram-positiivsed eosteta anaeroobsed bakterid (Mandell jt 2010). Actinomyces spp on harva põletiku põhjustaja. Neid võib avastada emakasisese spiraali kandmise korral (Kaya jt 2013). Reeglina ei kutsu nende olemasolu esile kliinilisi sümptomeid, kuid mõnel naisel võib esineda kõhuvalu, valulikku menstruatsiooni (Güdücü jt 2012). Bakterid paiknevad kuhjunult basofiilsete druusidena („vatitupsudˮ), mis koosnevad hargnevatest niiditaolistest struktuuridest. Tavaliselt on kera keskel läbipaistmatu ühtlane mass, milles ei saa eristada mikroorganisme; kera perifeerias paiknevad selgelt eristatavad niidid (joon 18), mida peetakse iseloomulikuks tunnuseks (Solomon ja Nayar 2004).
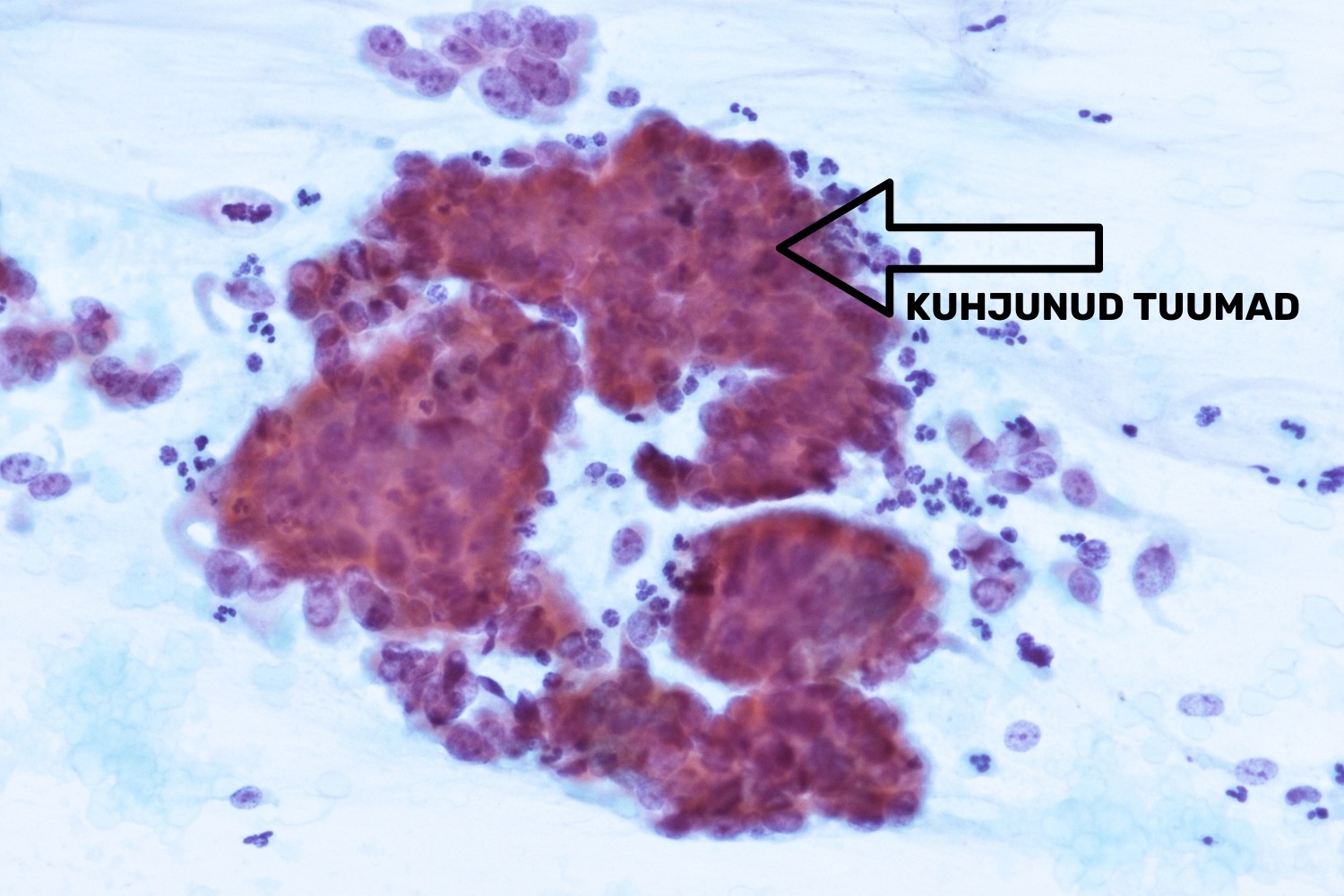
Herpes simplex viirus (HSV) on DNA-viirus, mis integreerub lameepiteeli rakkudega, sisenedes rakutuumadesse (Roxby jt 2011). Eriti tundlikud viiruste suhtes on transformatsioonitsooni piirkonna metaplastilised rakud. HSV infektsiooni tulemusena tekivad suured, klaasjate tuumadega, suhteliselt vähese tsütoplasmaga rakud tuumasiseste inklusioonidega (joon 19). Esineb tuumade kuhjumist, mis justkui pressivad üksteise vastu, moodustades seeläbi multinukleaarseid hiidrakke. HSV tunnused äigepreparaadis on seega järgmised:
- kuhjunud tuumadega multinukleaarsed rakud;
- tuumades ilmnev klaasjas kromatiin inklusioonidega.

HSV infektsiooni korral on diferentsiaaldiagnostika mõnikord raskendatud, kuna rakumuutus võib meenutada lameepiteeli tugeva astme düsplaasiat (HSIL) või reaktiivse silinderepiteeli rakku (Solomon ja Nayar 2004).
Mittespetsiifiliste põletike hulka võib lugeda atroofilist vaginiiti (joon 20). Nagu nimi viitab, esineb see põletik atroofilise lameepiteeli korral, kui on pärsitud limaskesta normaalne ehitus. Esineb tihti vanemas eas naistel. Kuna postmenopausis on östrogeenide produktsioon vähene, siis on pärsitud rakkude küpsemine ja limaproduktsioon; tekib tupekuivus ning kroonilise kuluga põletik. Atroofilist põletikku iseloomustavad degeneratiivsed muutused epiteeli rakkudes ja leukotsüütides ning lisaks on tõusnud leukotsüütide arv. Kuna tsütoloogiline pilt on küllaltki spetsiifiline ― valguline detriitne foon ja atroofilised reaktiivsete muutustega lameepiteelirakud ― siis on PAP-test selle diagnoosimiseks igati näidustatud.
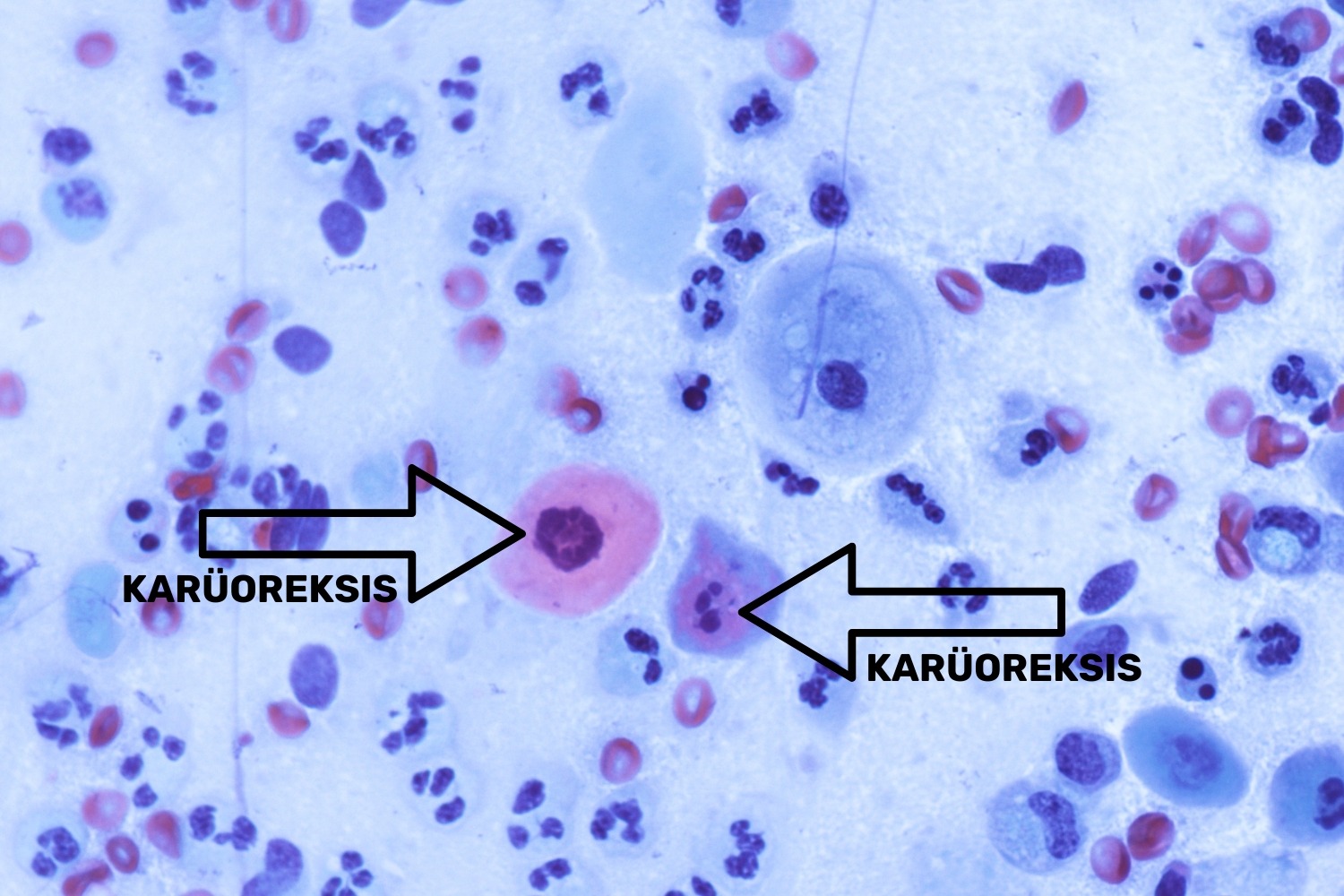
Kolpiitide või tservitsiitide puhul on rakuline materjal väga õrn ning seda võib võtmise käigus kergesti vigastada, mille tagajärjel tekib tuumakahjustus ehk karüoreksis (joon 21) ning tuuma lüüsumine ehk karüolüüs.
Gardnerella vaginalis kujutab endast väikest pulgataolist Gram-negatiivset kokobakterit, mis Papanicolau värvingus omandab sinise värvi (joon 22). Selle bakteri põhjustatud bakteriaalse vaginoosi puhul tõuseb tupe pH-tase 7−10 (normipärasest aluselisem keskkond). Kliiniliselt on näha valkjat voolust, millel on iseloomulik lõhn. Gardnerella vaginalis nakkuse korral esinevad PAP-testis “võtmerakud” (“Clue” rakud). Võtmerakud on lameepiteeli pindmise ja vahekihi rakud, mis on üleni tihedalt kaetud bakteritega, kuid eriti tihedalt tsütoplasma äärtes. Neid on väga kerge eristada teistest rakkudest, kuna nad paistavad tumeduse tõttu teiste rakkude seast hästi välja. (Brotman 2011)
Bethesda süsteemi alusel on PAP-testi eesmärk hinnata emakakaela epiteeli rakke ning määrata vähieelseid seisundeid ja kasvajaid. PAP-testil on madal spetsiifilisus ja sensitiivsus põletikutekitajate suhtes. Näiteks Candida albicans infektsiooni PAP-testi tundlikkus on vaid 25,25% (Avwioro jt 2010). Samas, kui äiges on avastatud eespool mainitud infektsioonide tekitajaid, tuleb neid vastuses kindlasti kajastada. (Solomon ja Nayar 2004)
3.1.2.4. Atüüpiline lameepiteel
Bethesda süsteemi järgi jaotatakse atüüpiline lameepiteel viieks astmeks:
- ASC-US ehk atüüpilised lameepiteelirakud, määramata olulisusega;
- ASC-H ehk atüüpilised lameepiteelirakud, kuid ei välista HSIL ehk tugeva-astme düsplaasiat;
- LSIL ― nõrga-astme düsplaasia;
- HSIL ― tugeva-astme düsplaasia (Ca planocellulare in situ ― CIS);
- Carcinoma planocellulare ehk squamocellulare ― lameepiteliaalne vähk.
ASC-US ja ASC-H on piiripealsed rakumuutused, mille tõlgendamine on raskendatud.
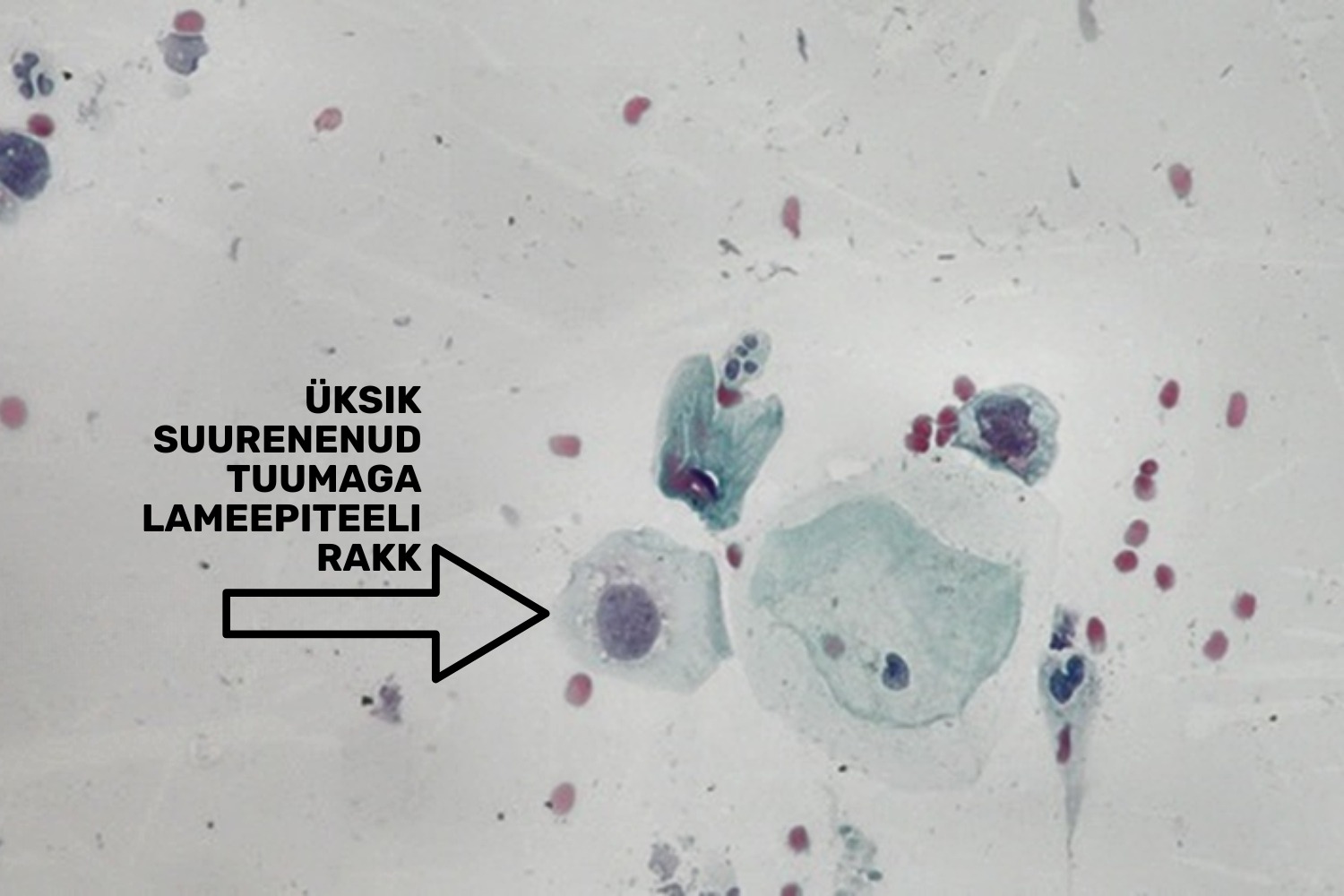
ASC-US (Atypical Squamous Cells of Undetermined Significance) on normi ja düsplaasia vahepealne diagnoos, mida kasutatakse siis, kui atüüpiliste muutustega lameepiteelirakke esineb vähe, kuid esineb kahtlus nõrgale düsplaasiale (LSIL). Samuti kohaldatakse seda diagnoosi siis, kui rakumuutused on rohkem väljendunud kui reaktiivsuse korral, kuid pole siiski kvalitatiivselt piisavad LSILi diagnoosimiseks. Mikroskoopilise leiuna võib esineda tuuma suurenemine 2.5-3 korda (joon 23) võrreldes normipärase vahekihi rakuga; tuuma/tsütoplasma suhte minimaalne tõus; tuuma suuruste varieerumine; kahetuumsed rakud. Võimalik on nõrk tuuma hüperkroomsus, kuid kromatiin jaotub ühtlaselt, puudub granulaarsus. Tuumakontuurid on ühtlased, võimalik on väga vähene ebaühtlus.
ASC-US diagnoosi kasutatakse ainult ebaselge tsütoloogilise pildi korral.
ASC-H (Atypical squamous cells, cannot exclude high grade intraepithelial lesion) on valikdiagnoos siis, kui rakumuutustega rakkude hulk on ebapiisav, et diagnoosida tugeva-astme düsplaasiat (HSIL) (Solomon ja Nayar 2004).
LSIL ― nõrga-astme lameepiteeli düsplaasia (Low Grade Squamous Intraepithelial Lesion), märgib emakakaela lameepiteeli rakusiseseid muutusi, mida iseloomustab tuuma/tsütoplasma suhte mõõdukas tõus, tuumade hüperkroomsus ning kuju muutus; samuti võib esineda kromatiini peen granulatsioon ja kerge ebaühtlus. Tihti võib leid atüüpiliste koilotsüütide esinemist, mis on otseselt seotud HPV-infektsiooniga (Clarke jt 2012).
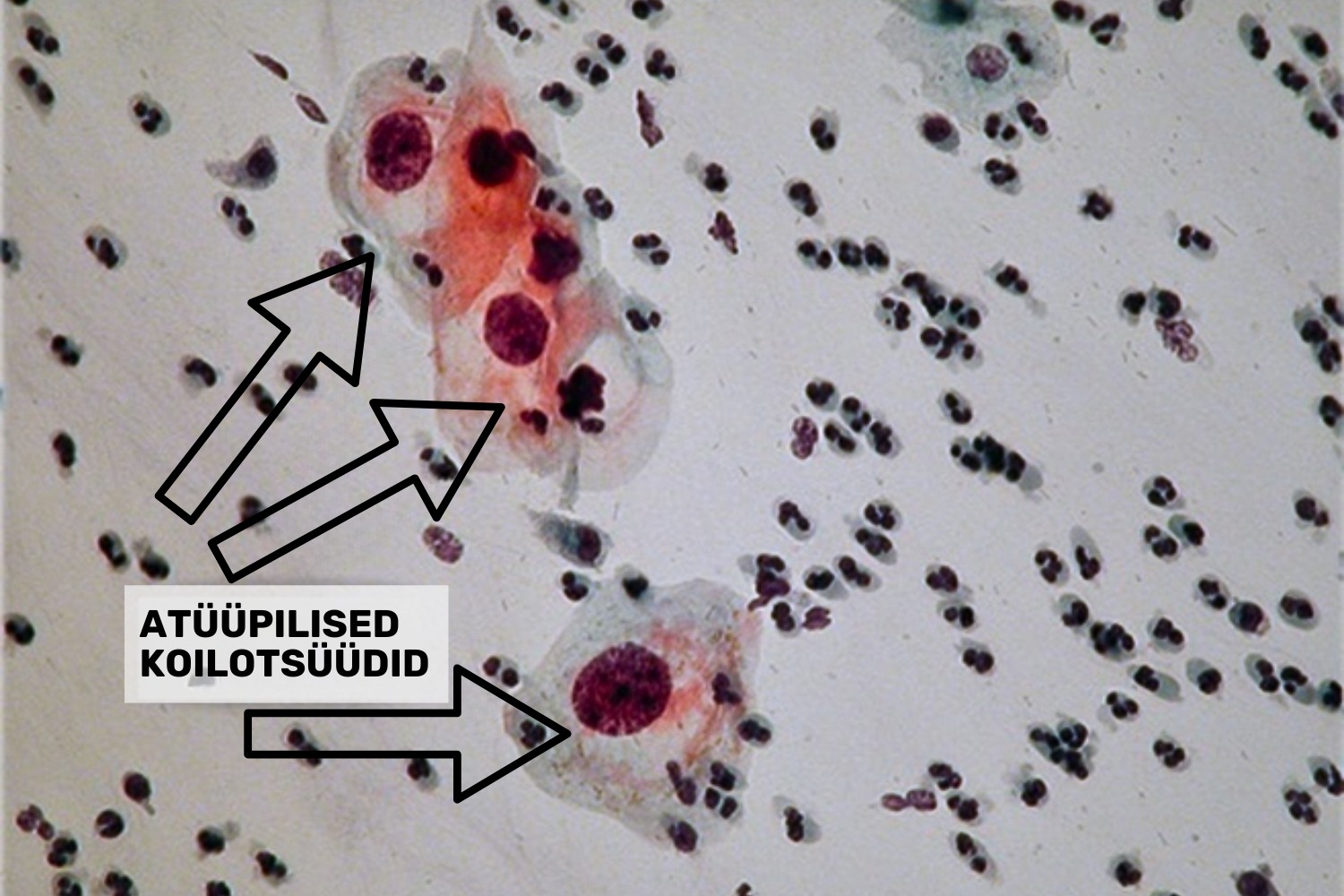
PAP-testi uuringumaterjali mikroskopeerimisel iseloomustatakse ilmselge HPV olemasoluga äigeid järgmiste tunnustega:
- atüüpilised koilotsüüdid;
- düskarioos;
- patoloogiline keratinisatsioon, hüperkeratoos, parakeratoos, düskeratoos;
- rakkude mitmetuumsus (Titmuss ja Adams 2009).
Kõige konkreetsem HPV-infektsiooni tunnus on koilotsüütide esinemine (joon 24). Koilotsüüt on lameepiteeli rakk, mille tuumal on vähemalt nõrga-astme düsplaasia tunnused (LSIL): tuuma/tsütoplasma suhte suurenemine, hüperkroomsus, tuuma kuju muutus (joon 25) ja iseloomulikud perinukleaarsed tsütoplasma halod.
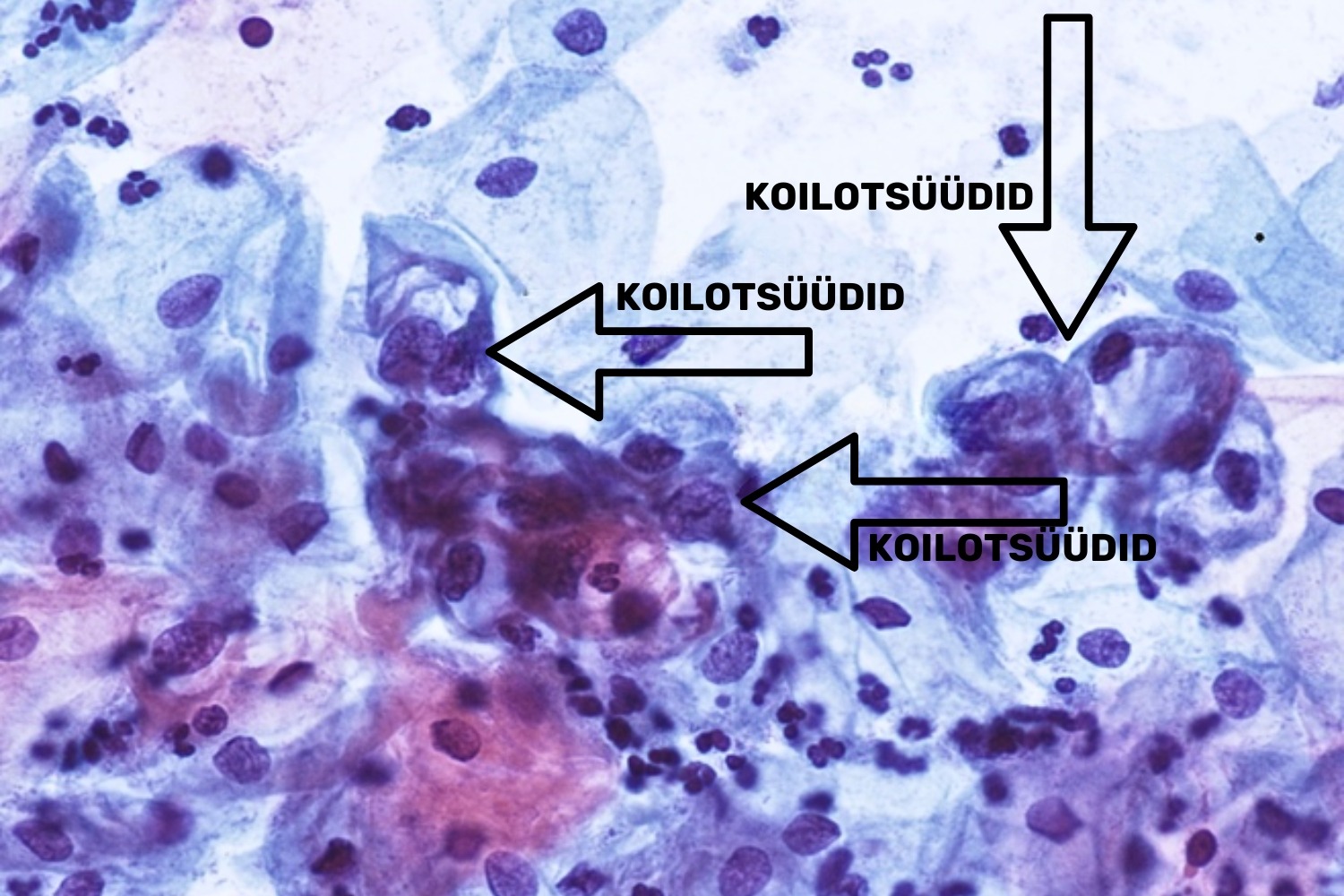
HSIL — mõõduka või tugeva-astme düsplaasia (High Grade Squamous Intraepithelial Lesion)
Mõõduka ja tugeva düsplaasia (HSIL) korral hõlmab atüpism 2/3−3/3 epiteeli paksusest. Kuna tsütoloogias ei ole võimalik hinnata epiteeli kui tervikut, siis Bethesda süsteem ei erista mõõdukat düsplaasia astet tugevast — mõlemad variandid kuuluvad HSILi alla.
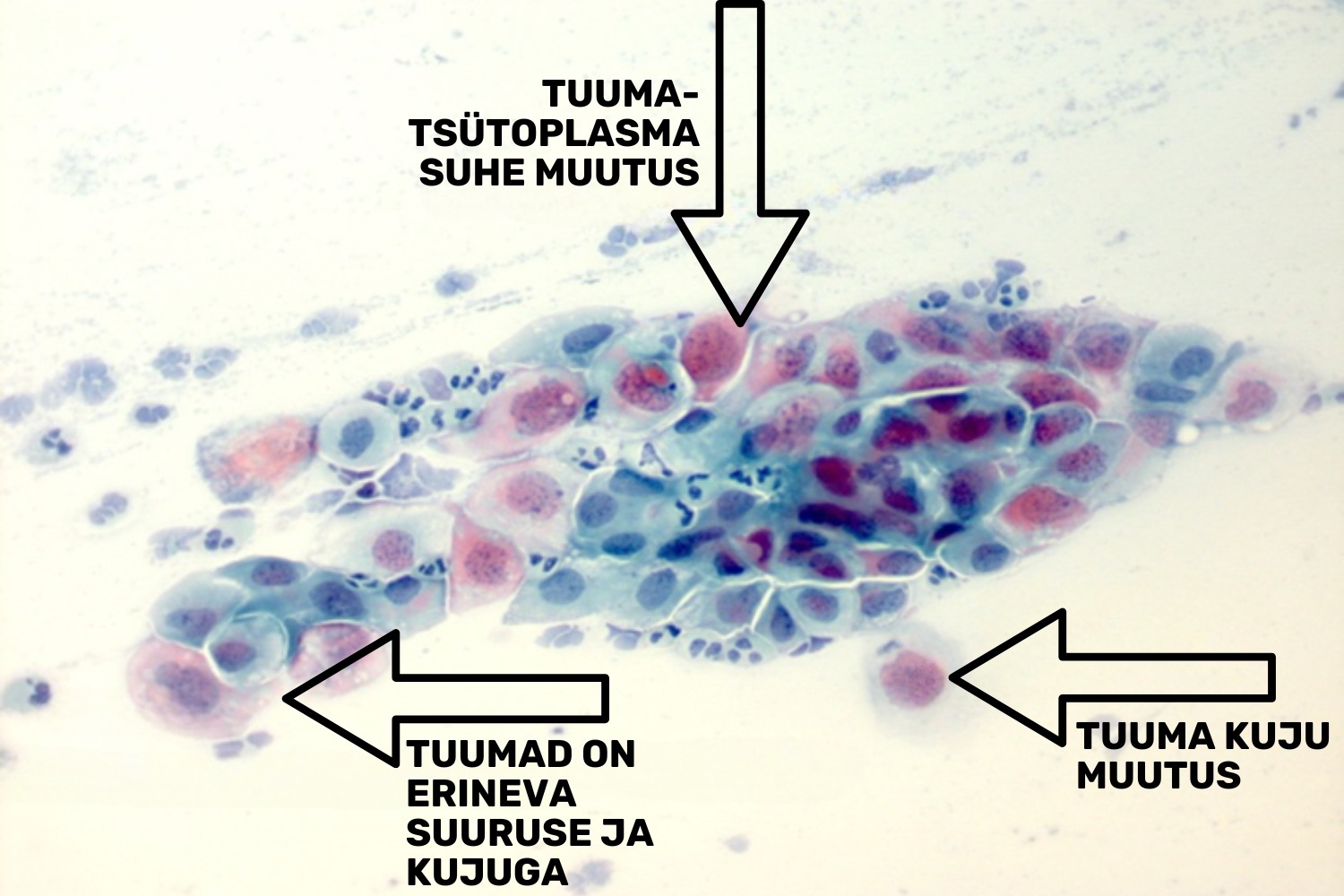
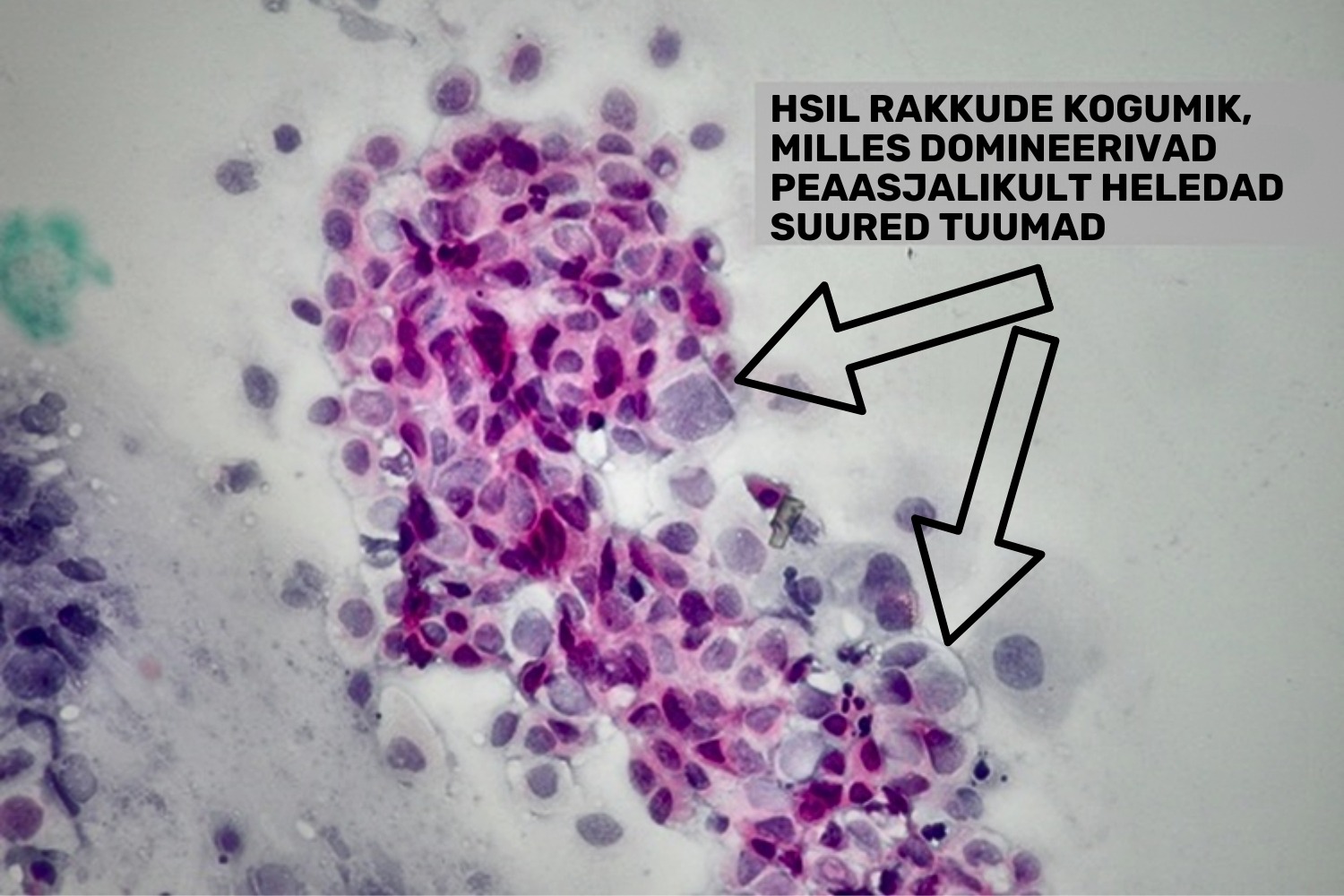
HSILi puhul avaldub atüpism väheküpsenud süvakihi rakkudes, mistõttu atüüpilised rakud on LSIL rakkudega võrreldes väiksemad, polümorfsemad. Tuuma/tsütoplasma suhe on drastiliselt muutunud, tsütoplasmat on vähe ja sageli on see vaevu eristatav (joon 26). Kromatiin on ebakorrapäraselt paiknev, esindatud suurte graanulitena, kromatiini sees võivad esineda vaod — niisugusel juhul näeb kromatiin välja nagu mäestik. Tuumas esinev kromatiini hulk võib samas avalduda nii hüper- kui ka hüpokroomsusena, seega võib esineda ka heledate tuumadega HSIL rakuvariante (Mac DeMay 2005) (joon 27). Carcinoma in situ on HSIL üks variantidest. Seda mõistet kohaldatakse siis, kui düsplaasia esineb lameepiteeli kogu läbilõike ulatuses; invasiivsest vähist eristab seda vaid epiteeli ja strooma piiril paikneva basaalmembraani terviklikkus. Kui basaalmembraan saab protsessi edenedes läbistatud, on tegemist juba pahaloomulise kasvajaga (lamerakuline vähk).
Tsütoloogilises pildis on väga raske või sagedasti isegi võimatu eristada lameepiteliaalset kartsinoomi in situ tugevast düsplaasiast. Emakakaela lameepiteliaalset kartsinoomi võib jaotada kaheks:
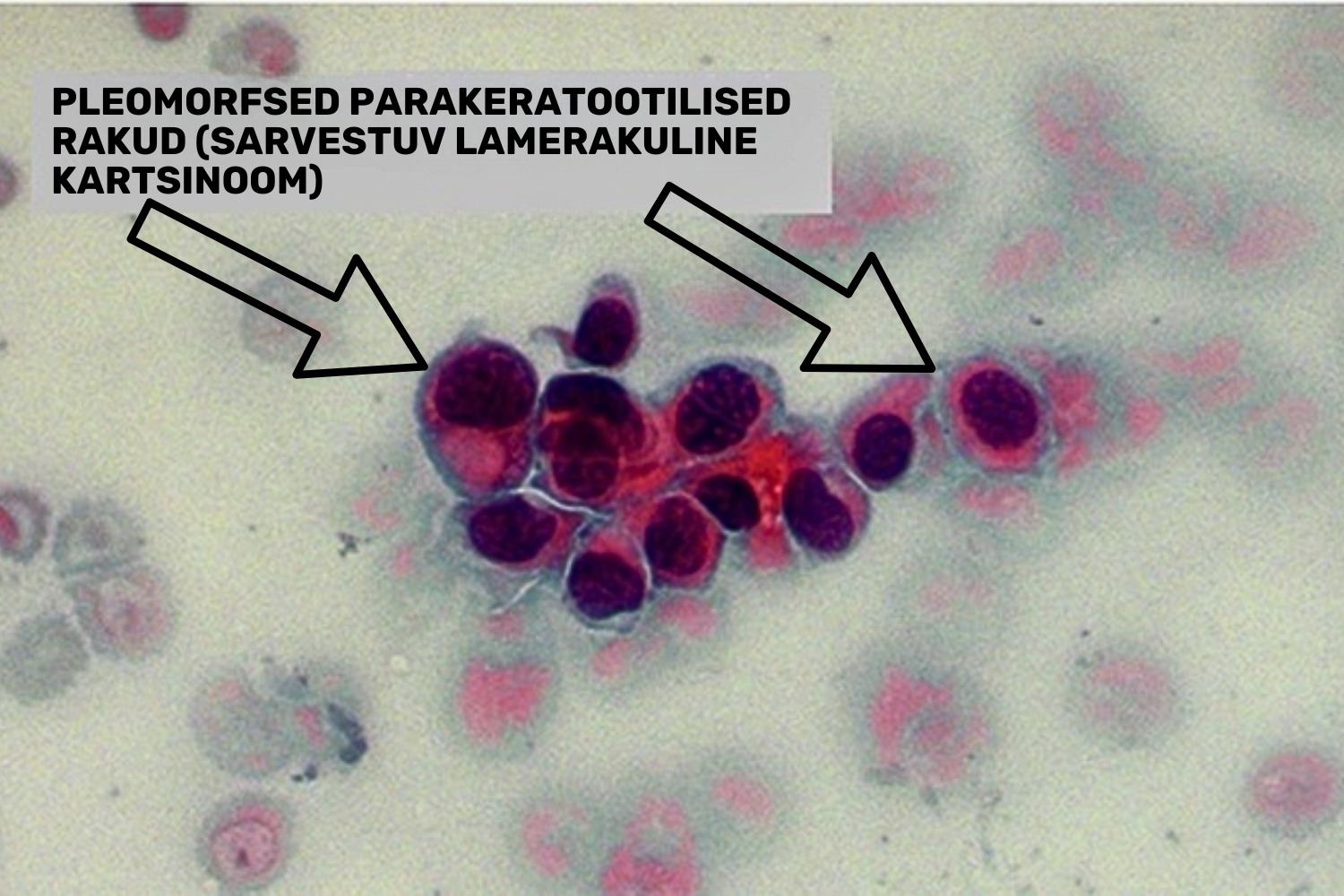
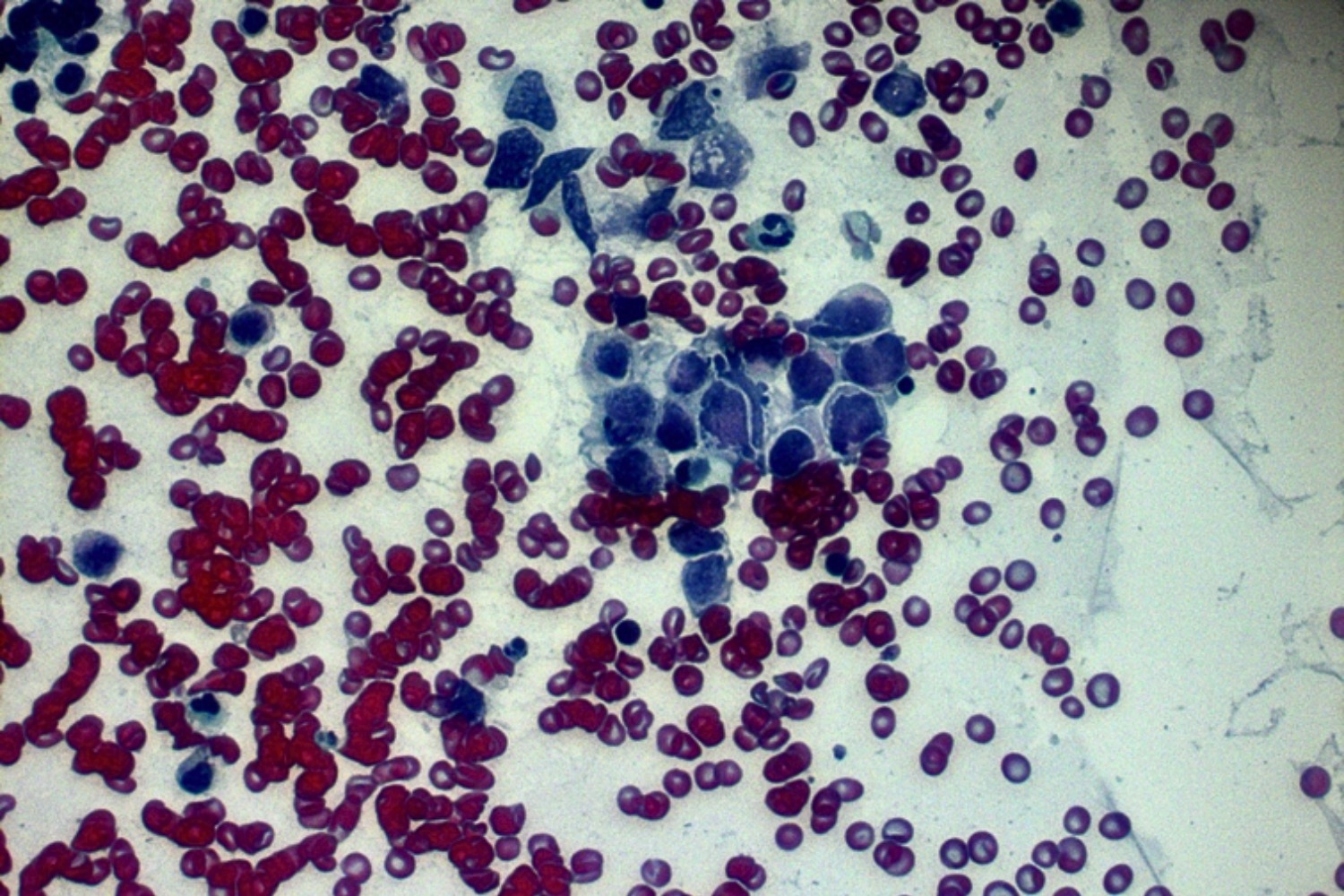
keratiniseerunud ehk sarvestunud ja keratiniseerumata ehk sarvestumata variandiks. Keratiniseerunud kartsinoomi puhul esinevad atüüpilise sarvainega täidetud düskeratootilised lameepiteeli rakud, mida Bethesda süsteem iseloomustab kui „pleomorfseid parakeratootilisi rakkeˮ (joon 28). Papanicolaou värving värvib need rakud intensiivselt punakas-oranžiks. Mittekeratiniseeruva kartsinoomi puhul domineerib rakkudes tumesinine värv. Kartsinoomi tunnusteks on lisaks atüüpilistele lameepiteeli rakkudele ka nekrootiline ja verine foon, mida nimetatakse tuumori diateesiks (joon 29).
3.1.3. SILINDEREPITEEL
3.1.3.1. Normipärane ja reaktiivne silinderepiteel
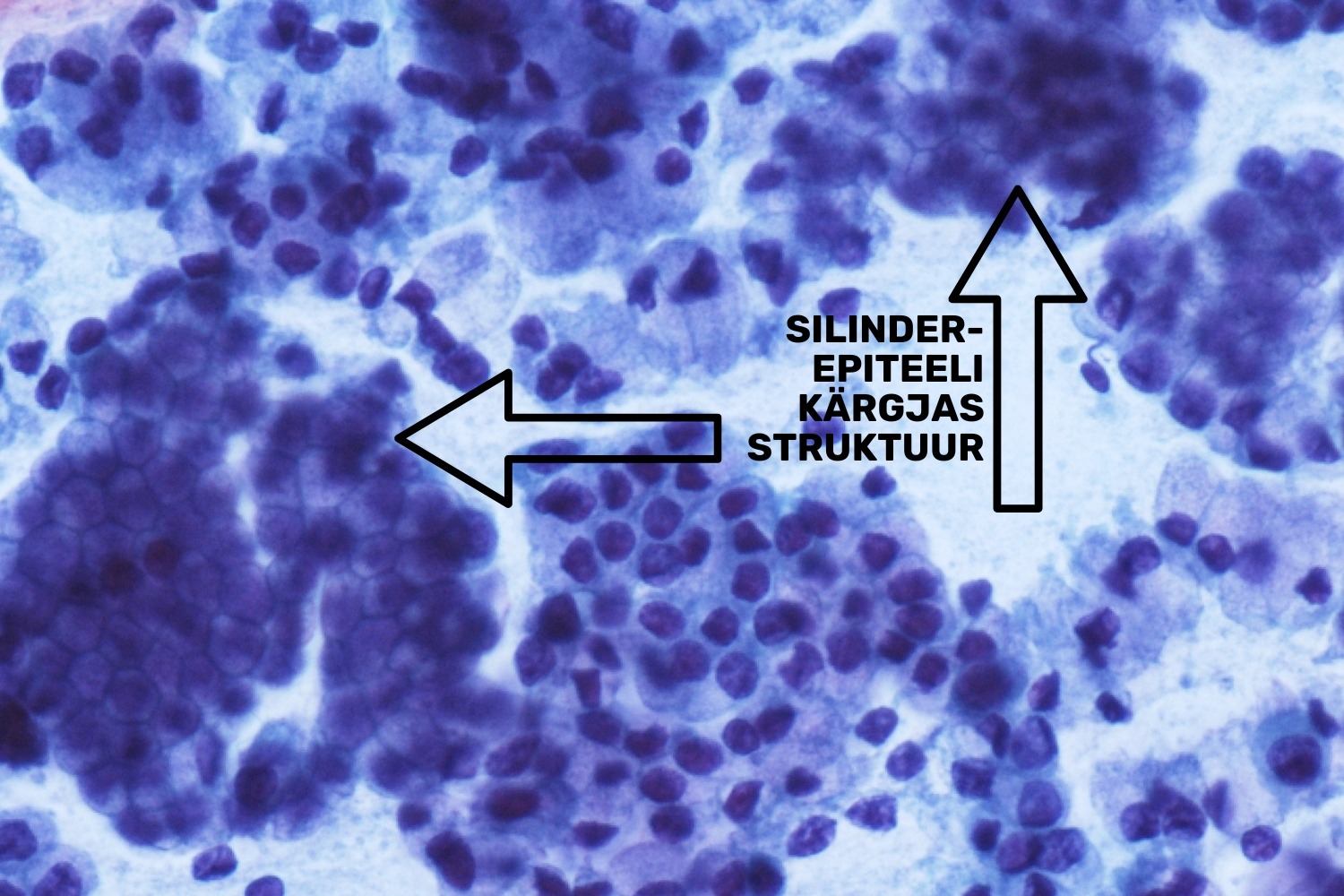
Ühekihiline näärme- ehk silinderepiteel vooderdab emakakaelakanalit. Emakakaelakanal ehk endotserviks on umbes 2,8 cm pikk torujas kanal, mis järk-järgult laienedes läheb sujuvalt üle emakaõõneks. Tsütoloogilisse uuringumaterjali sattuvad normipärased silinderepiteeli kogumikud on sagedasti pealtvaates, kärgja struktuuriga (joon 30).

Silinderepiteeli rakkude tuuma/tsütoplasma suhe võib pisut varieeruda olenevalt menstruaaltsükli päevast ja hormonaalsest foonist (Titmuss ja Adams 2009).
Reaktiivse silinderepiteeli rakkudel võivad olla järgmised omadused (joon 33):
- tuum on võrreldes normipärase silinderepiteeli raku tuumaga kuni viis korda suurem;
- mitmetuumsus;
- tuuma sees üks kuni mitu prominentset tuumakest;

- tsütoplasma värvub tihti oranžiks või roosaks. Seda nähtust nimetatakse pseudoeosinofiiliaks või amfifiilsuseks, mis tähendab, et rakud värvuvad hästi nii happeliste kui ka aluseliste värvidega ehk on kahevärvilise tsütoplasmaga;
- kärjeline struktuur on veidi häiritud ning tekib minimaalne tuumade kuhjumine.
Joonisel on näha muutusteta ja reaktiivse silinderepiteeli erinevus, samuti on siin hästi väljendunud tsütoplasma amfifiilsus (joon 33).
3.1.3.2. Atüüpiline silinderepiteel
2001. aasta Bethesda süsteemi järgi jaotatakse tservikaalkanali atüüpiline silinderepiteel kolmeks:
- AGC-NOS — atüüpiline silinderepiteel, tõenäoliselt reaktiivne või kindlaks määramata etioloogiaga;
- AGC-FN — atüüpiline silinderepiteel, tõenäoliselt neoplastiline;
- AIS — endotservikaalne adenokartsinoom in situ (Solomon ja Nayar 2004).
AGUS ehk Atypical Glandular Cells of Undermined Significance on Bethesda süsteemi vananenud, tänapäeval vähem kasutatav mõiste. Diagnoosi AGC-NOS kasutatakse reeglina siis, kui silinderepiteeli kogumiku kuhjumine on hästi eristatav (joon 34) ning tuuma/tsütoplasma suhe on tõusnud. Tuum võib suureneda 3−5 korda.
Esineda võib tuumade nõrka hüperkroomsust, tuumad võivad olla erineva suuruse ja kujuga. Rakkude piirid on ebaselged (Solomon ja Nayar 2004).
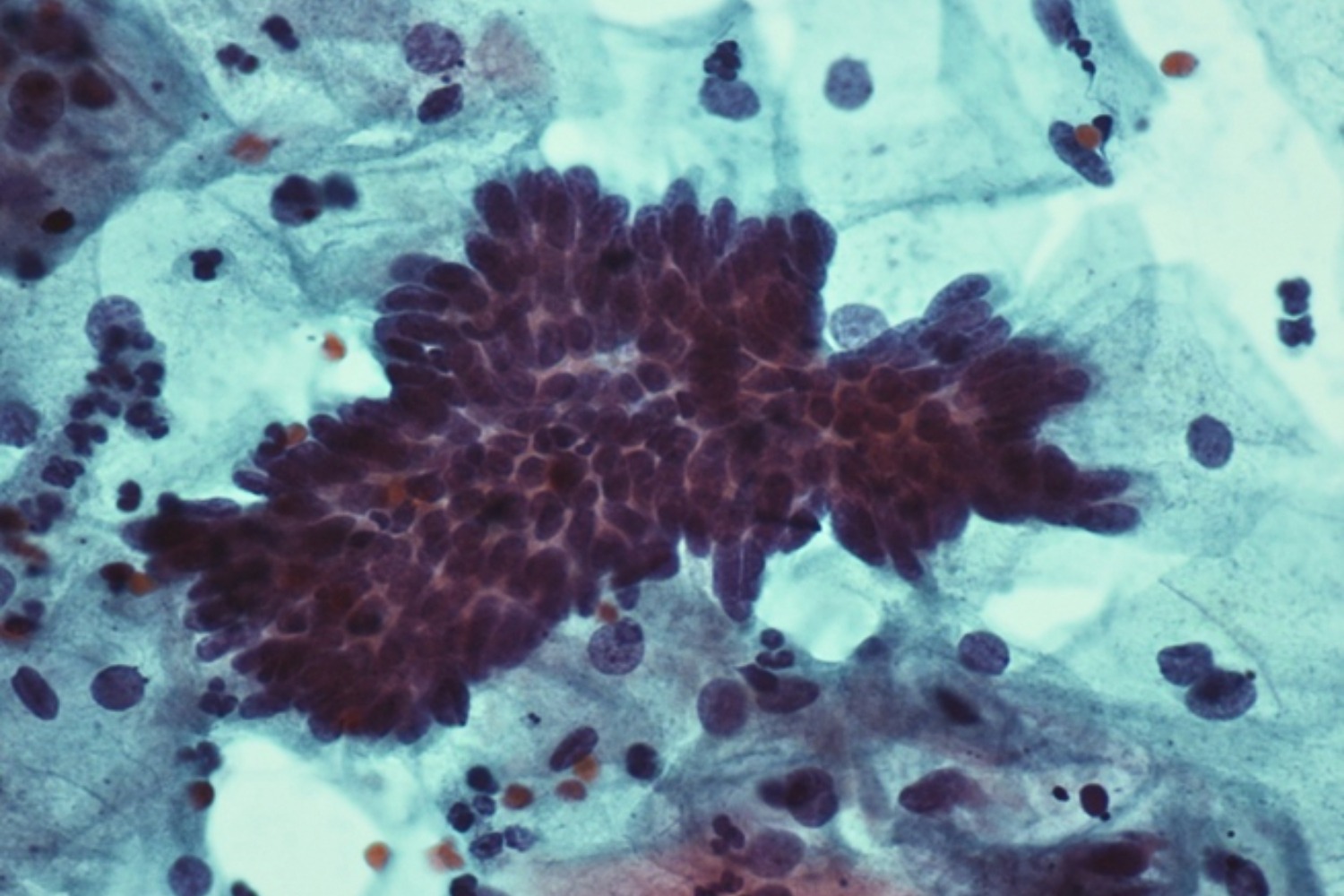
AGC-FN ehk Atypical Glandular Cells, Favor Neoplastic diagnoosi kasutatakse selleks, et kirjeldada muutusi, mis esinevad glandulaarses epiteelis, kuid mis on veel kas kvalitatiivselt või kvantitatiivselt ebapiisavad, et hinnata proovi kui adenokartsinoomi in situ (AIS) või adenokartsinoomi. Kriteeriumid, mille järgi diagnoositakse, on põhiliselt silinderepiteeli kogumiku struktuuri muutus ja tuumade muutus. Tuumad suurenevad kuni viis korda ning on tihti sigari-kujulised ning samuti on võimalik hüperkroomsus. Näärmeepiteeli kärgjas struktuur mitte ainult ei kuhju, vaid moodustab linnusuletaolisi struktuure, mida inglise keeles nimetatakse feathering. Võib öelda, et tuumad kaotavad oma loomuliku orientatsiooni ning liiguvad eri suundadesse ehk muutuvad bi-polaarseks. Teine struktuurimuutuse tunnus on pseudostratifikatsioon, mille korral silinderepiteel muutub justkui mitmekihiliseks (joon 35).
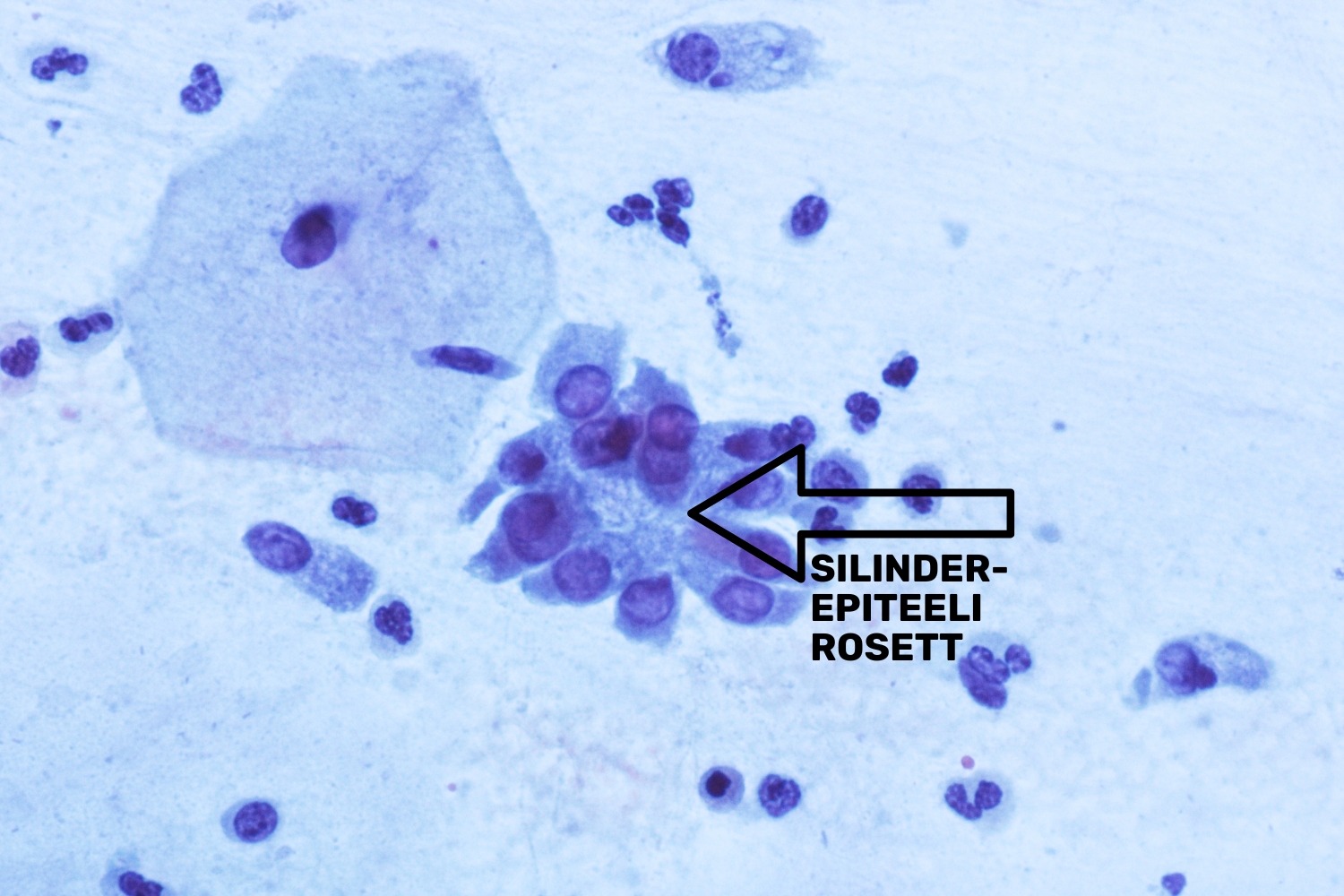
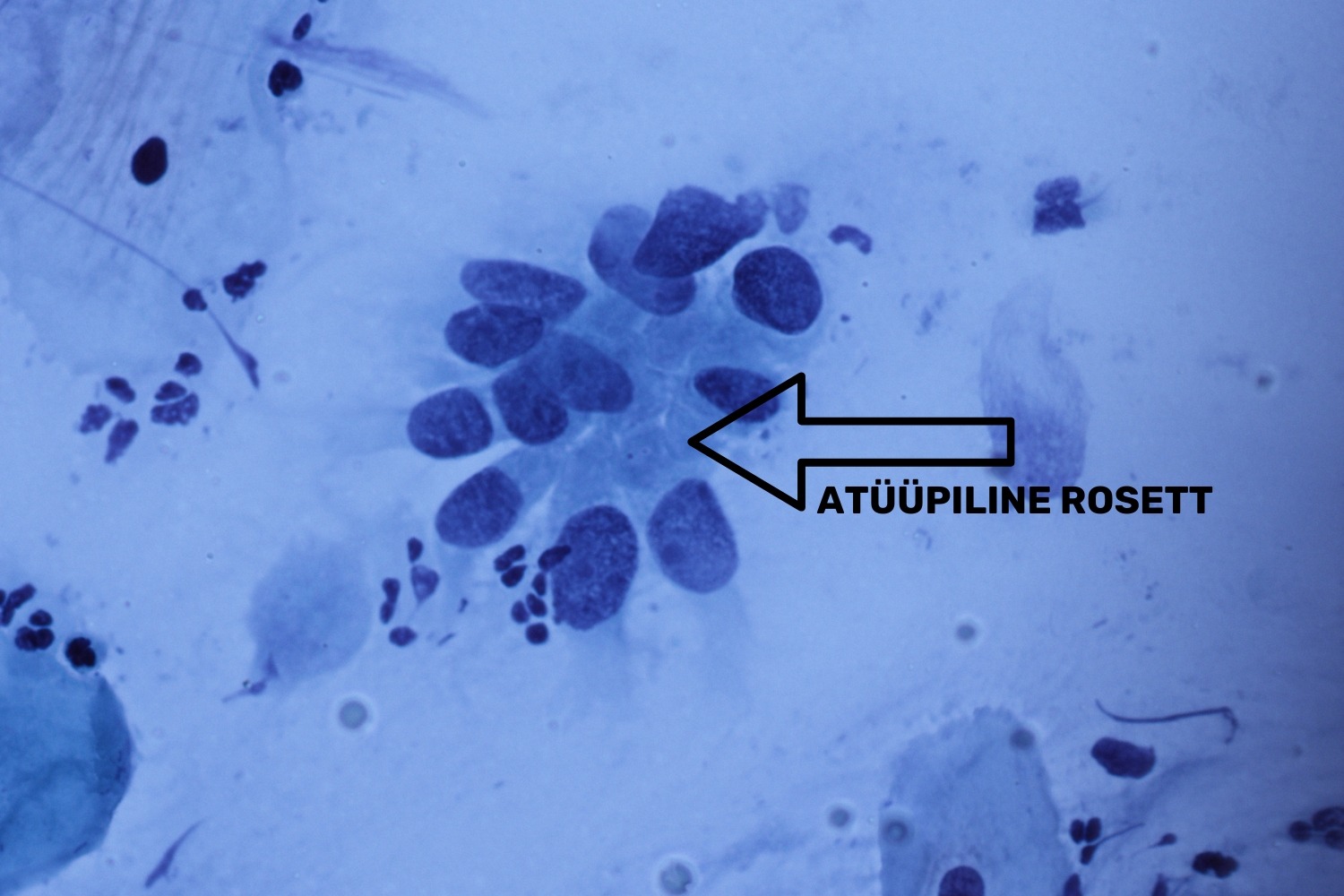
Tsütoloogilises preparaadis on üldiselt eristatavad endotservikaalse adenokartsinoomi in situ (AIS) tunnused, mida iseloomustavad suured bi-polaarsed, erinevatesse suundadesse orienteeritud hüperkroomsed tuumad. Samuti võib näha mitootilist aktiivsust, kuid kõige selgem tunnus on muutunud näärmelise epiteeli rosettide olemasolu preparaadis, mille järgi saab AIS-i kergemini ära tunda. Muutunud tuumadest rosetid (tsütoplasma on tuumade taustal vaid pisut märgatav) on reeglina väga „puhtalˮ foonil, kus puudub veri ning nekroos (joon 36). AIS on mitteinvasiivne protsess, seetõttu ongi foon puhas. Silinderepiteeli düsplastilised rakud esinevad väikeste kogumikena ning üksikuid muutunud rakke ei täheldata (Solomon ja Nayar 2004).
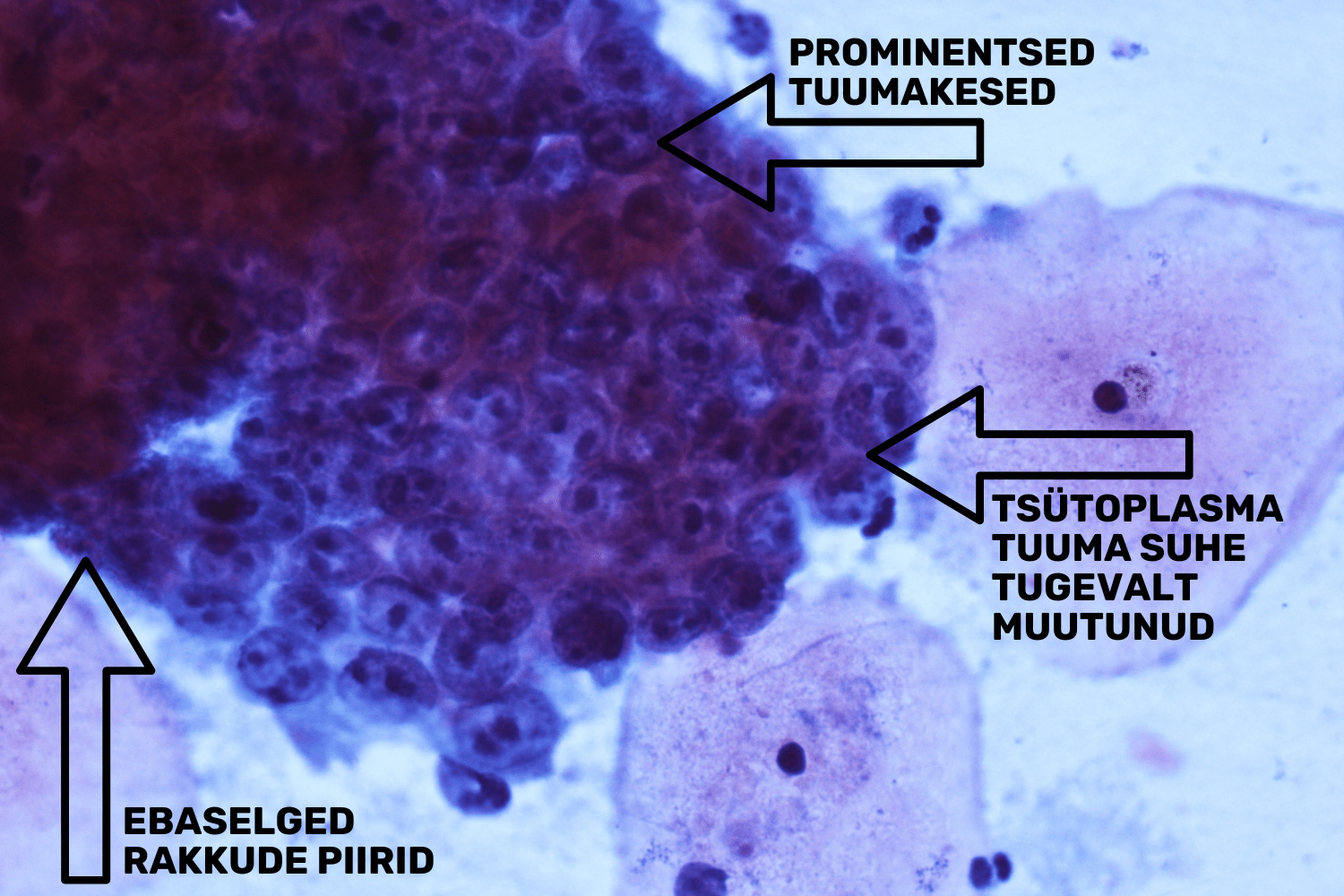
Endotservikaalse adenokartsinoomi tunnusteks on „räpaneˮ foon, kus esinevad nekroos ja veri (invasiivsuse tunnused). Silinderepiteeli kogumikud võivad varieeruda — need on kas kahe- või kolmemõõtmelised, samuti võib esineda ka üksikuid tugevalt atüüpilisi silinderepiteeli rakke. Rakud on kogumikus koos ning üksiku raku tsütoplasma piirid on hägused ja mitteeristatavad. Prominentsete tuumakeste (macronucleoli) olemasolu raku tuumas kinnitab maliigsuse diagnoosi veelgi. Tuumad on suurenenud ning erineva kuju ja suurusega. Kromatiin on ebaühtlaselt jaotatud ning tuuma membraan on ebakorrapärase kujuga (joon 37).
3.1.4 ENDOMEETRIUMI RAKUD PAP-TESTIS
PAP-testis võib leida emaka näärmelise epiteeli ehk endomeetriumi rakke. Põhjuseid võib olla mitmeid:
- menstruatsiooni ajal võetud proov — kui test võetakse veritsuse ajal või vahetult peale menstruatsiooni;
- emakasisese rasestumisvastasevahendi (ESV) ehk spiraali kandjal — ESV (IUD) muutused;
- vale võtmistehnika rakendamine — günekoloog või ämmaemand võtab emakakaelakanalist materjali liiga kõrgelt, sattudes emaka alumisse ossa;
- endometriaalse polüübi korral, kui polüüp ripub kanalis ja materjali kogudes satuvad endomeetriumi suured hargnevad kogumikud kanali materjali;
- endomeetriumi pahaloomuliste kasvajate puhul eralduvad papillaarsed rakukogumikud emaka seinalt ning suunduvad kanalisse ja portsiole.
Deskvamatsioonifaasi ajal irdub endomeetrium, mis väljub koos verega emakast tuppe ning seega ka PAP-testi prooviklaasile. Preparaadis näeme irdunud endomeetriumi lagunemise tunnustega kogumikke, mida nimetatakse „eksodusˮ (exodus). See on kolmemõõtmelise struktuuriga pallikujuline kogumik (joon 38). Tuumad on ümarad väikesed, umbes vahekihi lameepiteeli raku suurused. Eksodustega kaasneb preparaadis veri. Menstruatsioonile eelneval ja veritsuse ajal on PAP-testis rohkesti neutrofiile, mis on infiltreerunud ka rakukihtide kogumikesse, nt metaplaasia kogumikesse. Tuleb olla väga tähelepanelik ja jälgida saatekirjal informatsiooni menstruaaltsükli kohta, sest vastasel juhul võib ekslikult pilti hinnata põletikuliseks.
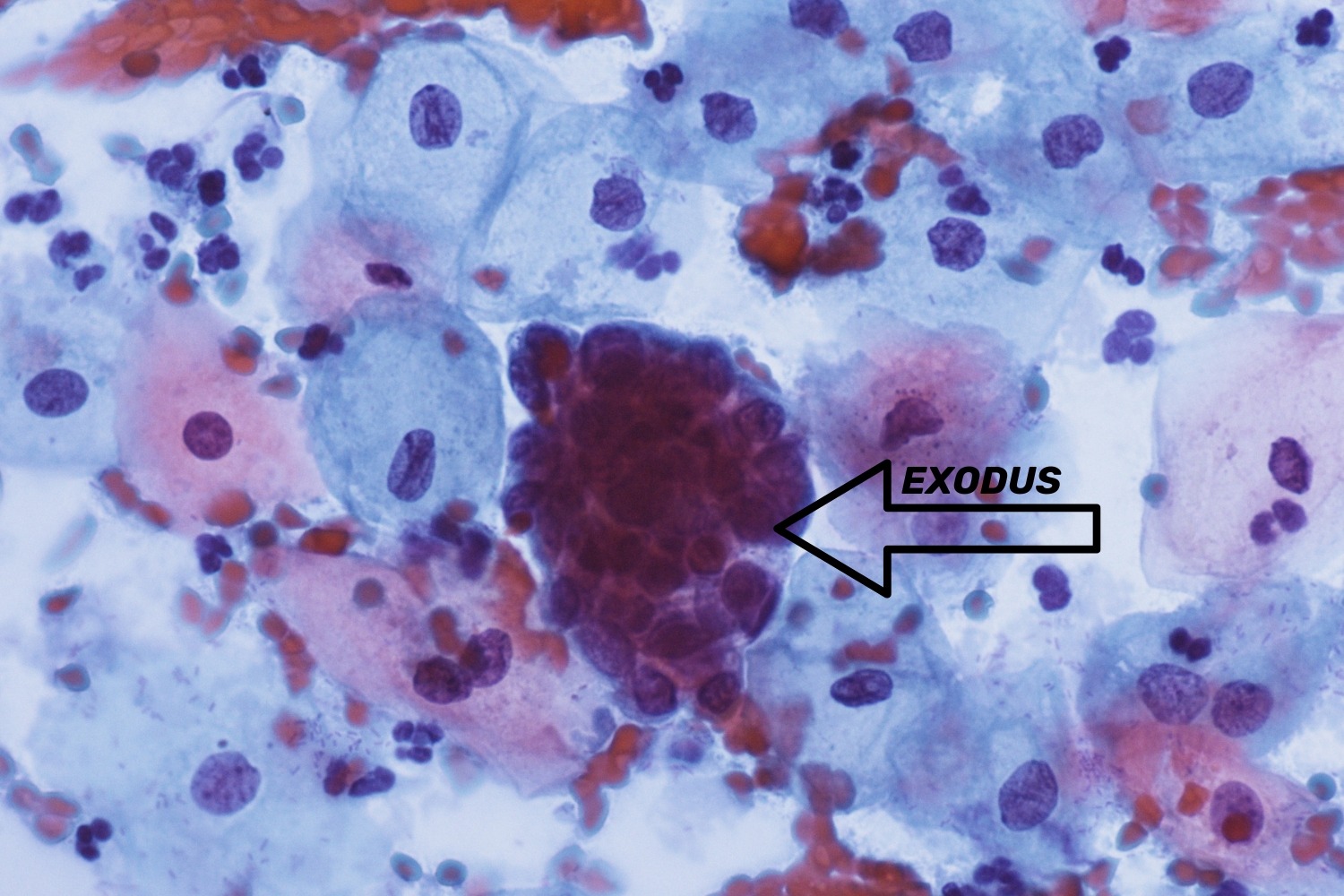
Eksodused on nähtavad kuni 12 päeva peale veritsuse algust. Spiraalikandjate puhul loetakse normiks eksoduse esinemist kuni 16 päeva peale veritsuse algust. Kui eksodused esinevad menstruaaltsükli teisel poolel, siis võivad need olla atüüpilised endomeetriumi rakud. Eriti tähelepanelik tuleb olla patsientide puhul, kes on üle 40 aastased naised, nendel nõuab Bethesda süsteem endomeetriumi kirjeldust selle esinemise korral PAP-testis.
Tservikaalkanali materjali võtmise ajal võib günekoloog kergelt haarata harjakesega emaka alumist osa. Ebakorrektse metoodika rakendamisel või endometriaalse polüübi olemasolul satuvad klaasile emaka alumise segmendi strooma ja glandulaarsed rakud (joon 39). Endomeetriumi strooma rakud
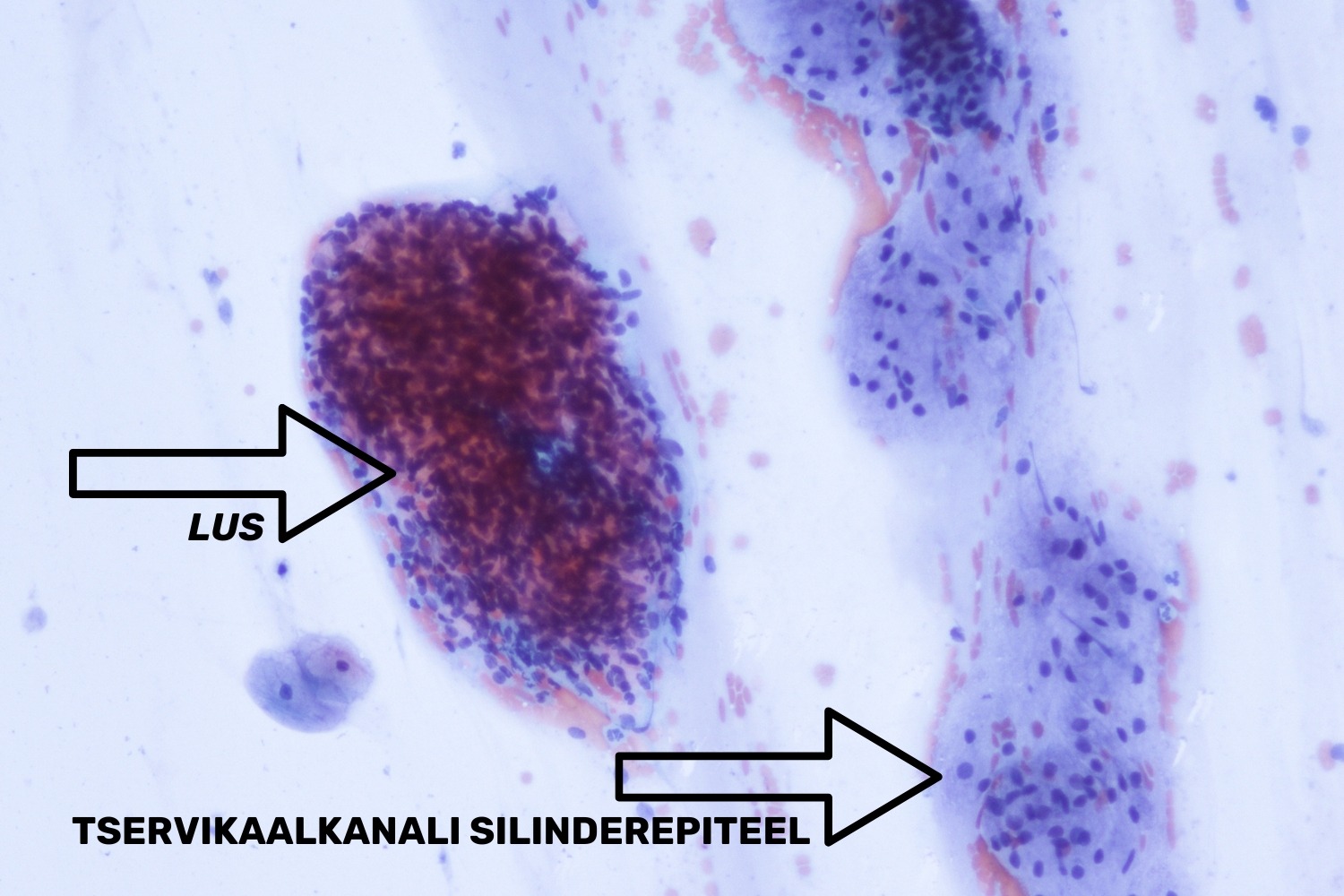
on ümara või ovaalse tuumaga ning väga vähese tsütoplasmaga. Emaka alumise segmendi rakukogumikel ei ole kärgjat struktuuri, vaid pigem on need kuhjunud tuumadega, mis raskendab diferentsiaaldiagnostikat. Algaja mikroskopeerija võib ekslikult arvata, et tegu on atüüpilise silinderepiteeliga. Emaka alumise segmendi rakkude tuumad on tihti degenereerunud, sest preparaatide valmistamisel lähevad strooma rakud sageli katki ning nende tuumade kuju muutub pikkadeks triipudeks nii öelda „sigri-migriksˮ, mis ei ole tservikaalkanali silinderepiteelile iseloomulik. Kuigi Bethesda süsteem ei nõua LUSi kirjeldamist PAP-testi vastuses, tuleb siiski eristada emaka alumise segmendi rakke tservikaalkanali silinderepiteeli rakukogumikest. (Solomon ja Nayar 2004)
Endometriaalse polüübi korral, mis ripub tservikaalkanalis, võib samuti PAP-testi klaasile sattuda endomeetriumirakke. Polüübile on iseloomulikud suured hargnevad endomeetriumi kogumikud (joon 40), mis on vohavad
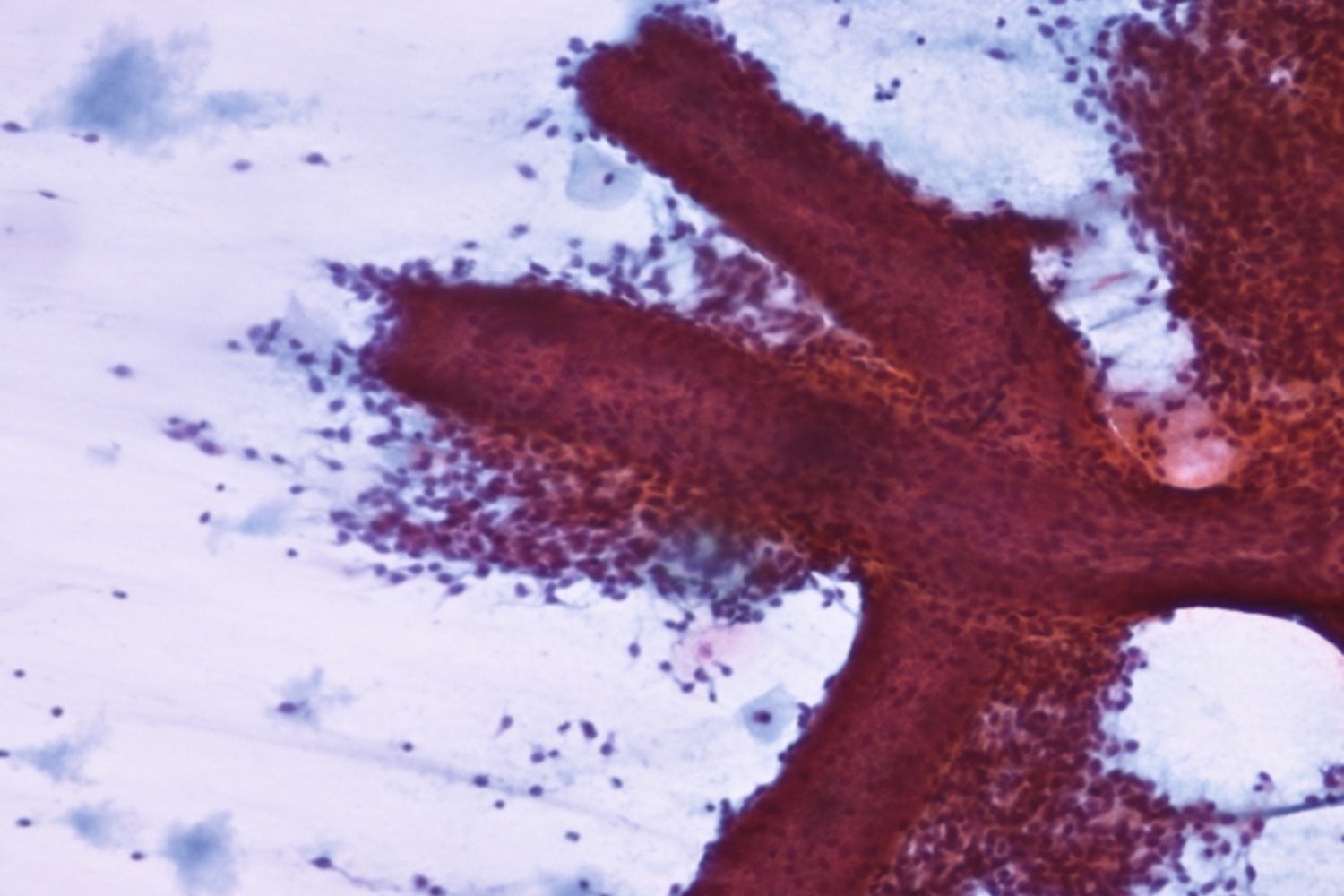
ja mille rakkude tuumad on kuhjunud. Tihti esinevad tuumakesed ja kromatiin võib olla sõmerjas. Tuumad on väikesed, väiksemad kui silinderepiteelil, ümarad kuni ovaalsed ning nende suurus ei varieeru.
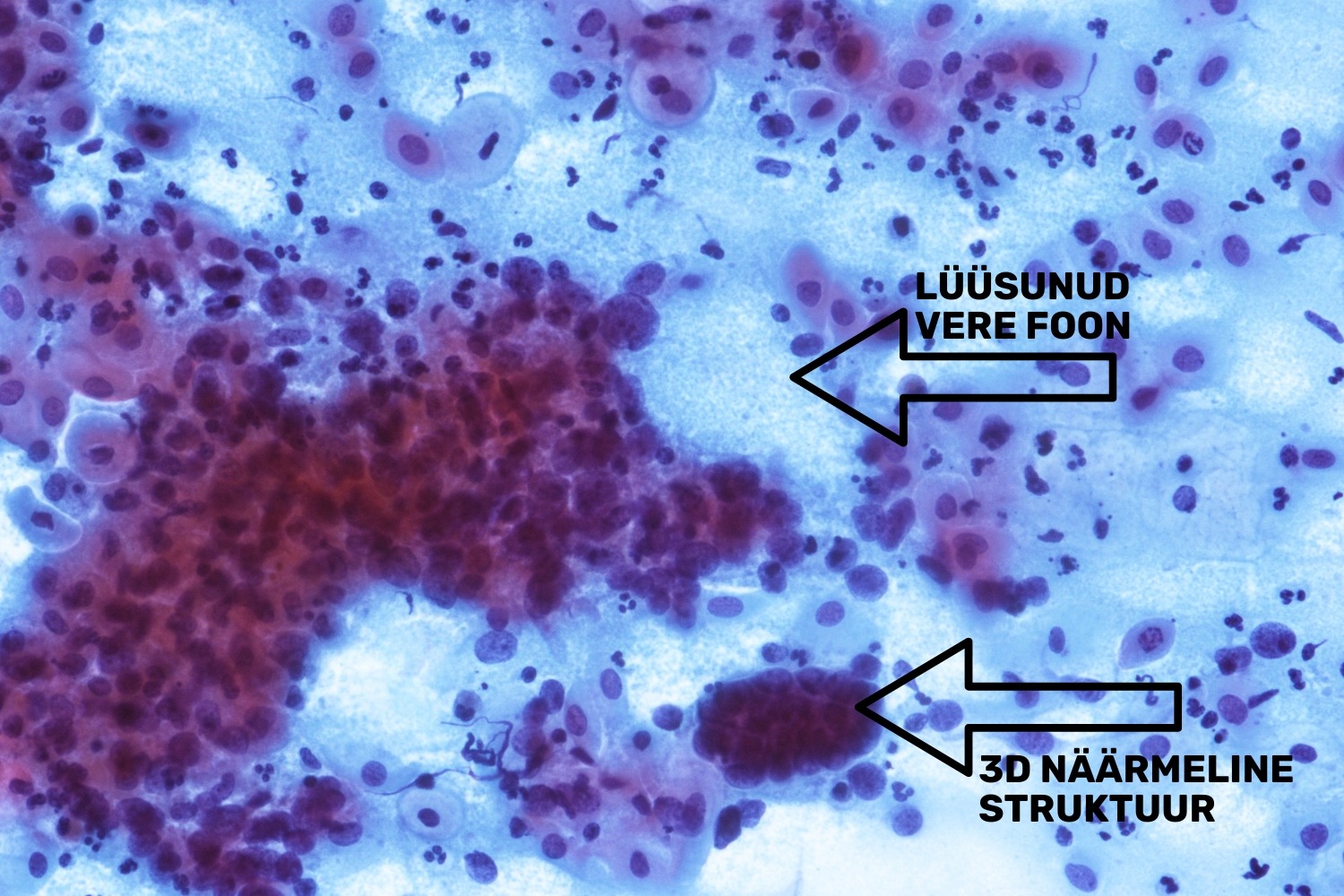
Endomeetriumi pahaloomuliste kasvajate puhul esineb PAP-testi materjalis endomeetriumi papillaarseid pallikujulisi 3D-struktuure. Maliigsete rakkudega kaasneb tuumori diatees, lüüsunud erütrotsüüdid ehk „vana veriˮ ja samuti võib esineda üksikuid atüüpilisi endomeetriumi rakke (joon 41, 42). Kui lameepiteeli atüüpia tunnusteks on muutused tuuma suuruses, kujus, värvuses

ning tuuma/tsütoplasma vahekorras, siis näärmeliste epiteelide hindamisel tuleb arvestada lisaks nendele muutustele ka kogumiku struktuuri. Normipärase silinderepiteeli struktuur on alati kärgjas ning tuumad paiknevad üksteise kõrval. Nõrga atüüpia korral tuumad kuhjuvad, kuid neoplastilise silinderepiteeli tuumad ei hoia enam kokku, vaid liiguvad eri suundadesse. Siinjuures tuleb kindlasti arvestada ka tuumade kuju ning suuruse muutusega, mitte pelgalt struktuuriga.
3.1.5. MUUTUSED SEOSES HORMONAALSE STAATUSEGA
Hinnates günekotsütoloogilist äiet on võimalik tuvastada nais-suguhormoonide taset. Samal ajal kui toimuvad menstruaaltsükli muutused munasarjas muutub tupe limaskest. Olenevalt östrogeenide tasemest domineerib PAP-testis ühe või teise kihi lameepiteeli rakud. Menstrueeriva naise günekotsütoloogilises preparaadis esineb tsükli esimesel poolel peamiselt lameepiteeli vahekihi rakke ning vähem pindmise kihi rakke (joon 43). Tsükli keskel on näha rohkem lameepiteeli pindmise kihi rakke (joon 44). Enne menstruatsiooni võib näha üksikuid lameepiteeli süvakihi rakke, kuid peamiselt esineb vahekihi rakke ning vähem pindmise kihi rakke. Enne menstruatsiooni suureneb ka neutrofiilide arv.
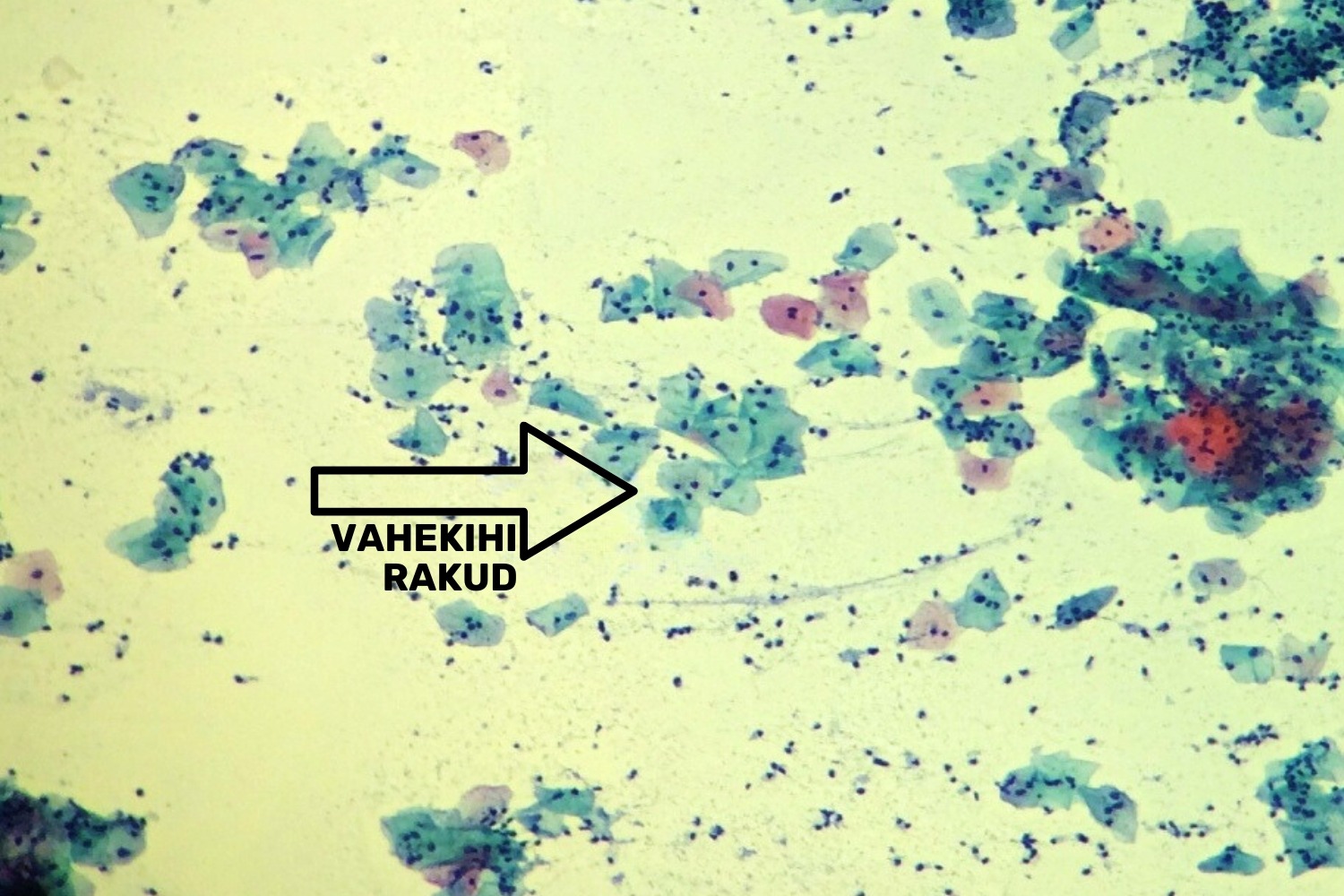

Postmenopausi naistel esinevad alguses PAP-testis peamiselt kas vahekihi rakud või vahekihi ja süvakihi rakud tsükliliste variatsioonideta. Hiljem domineerib parabasaal- ja basaalkihi ehk lameepiteeli süvakihi rakud (joon 45), kujuneda võib atroofia. Pindmise kihi rakke võib esineda postmenopausis oleva naise PAP-testis vaid üksikuid, näiteks põletike korral.
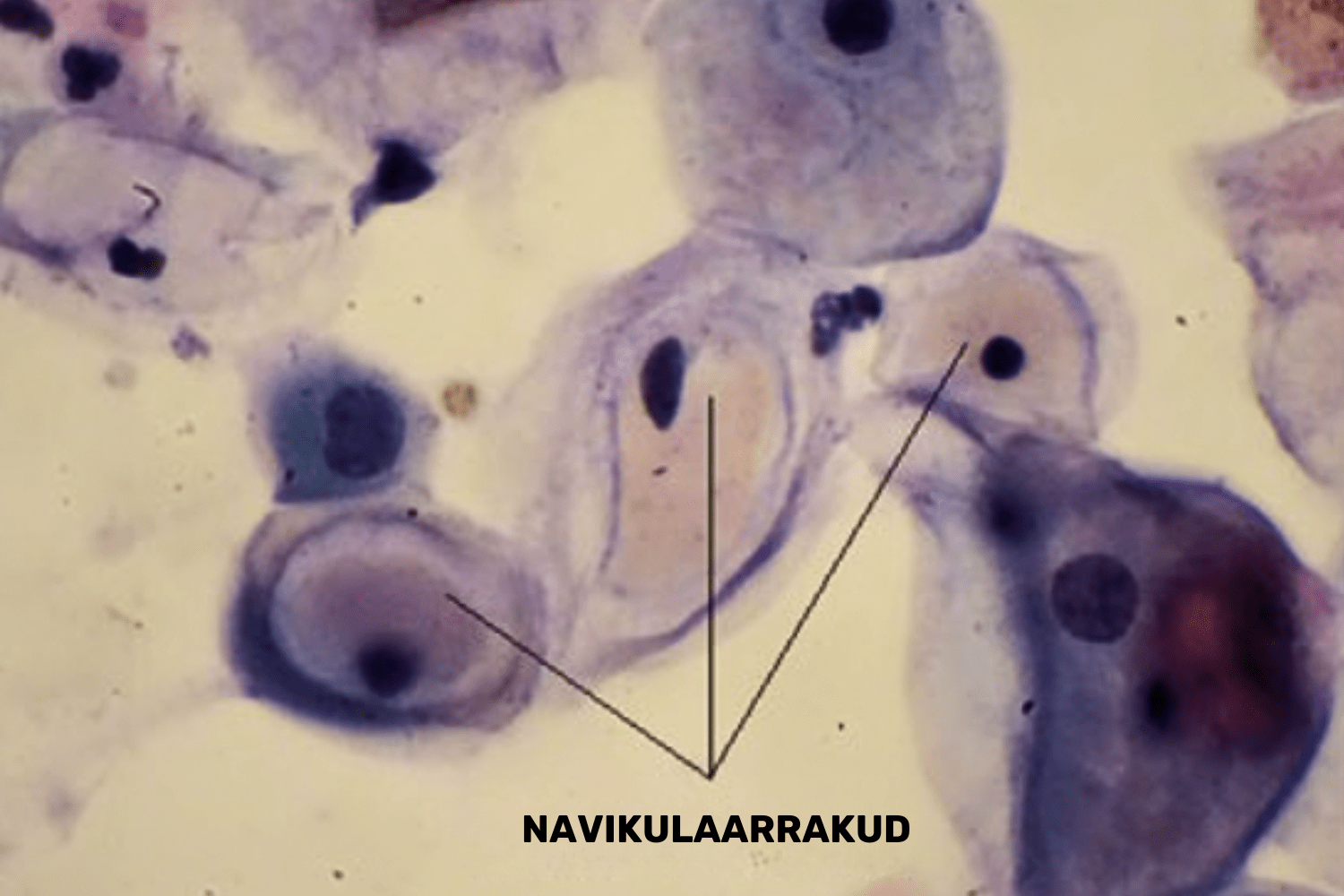
Eristatakse veel lameepiteeli navikulaarrakke, mis esinevad rasedatel. Navikulaarrakud on vahekihi rakud, mille tsütoplasmas esineb rikkalikult glükogeeni graanuleid, mis värvuvad kollakalt (joon 46). Sünnitusjärgselt ning laktatsiooni ajal prevaleeruvad günekotsütoloogilises äiges peamiselt vahe ja sügavakihi rakud ning võib esineda atroofiat.
3.1.6. MITTEADEKVAATSED PROOVID, PREANALÜÜTILISED VEAD JA ARTEFAKTID
PAP-testi hindamisel Bethesda süsteemi järgi hinnatakse esmalt, kas proov on adekvaatne või mitte. Adekvaatsus on väga oluline kvaliteedinäitaja ning aitab günekoloogil veenduda tulemuste usaldusväärsuses. Vanal Bethesda süsteemil (kuni 1991. a) oli kolm adekvaatsuse astet: adekvaatne, adekvaatne, kuid limiteeritud ja mitteadekvaatne. Praeguseks on limiteeritud adekvaatsuse staatus kaotatud ning 2001. aasta süsteemi järgi jäeti hindamiseks vaid kaks astet: adekvaatne ja mitteadekvaatne materjal. Adekvaatseks materjaliks loetakse proovi, kus on täidetud 3 tingimust. Vähemalt:
- 8000–12 000 lameepiteeli rakku. Hinnatakse luup-objektiiviga (4×), kui igas vaateväljas on ligi 1000 rakku, siis kokku on tarvis hinnata vähemalt 8 vaatevälja antud preparaadis; kui rakke on vähem, siis sellele vastavalt tuleb hinnata rohkem vaatevälju. Bethesda klassifikatsiooni käsitlevas raamatus on selle töö hõlbustamiseks ära toodud vastavad referents-joonised.
- üks metaplastiline kogumik või 10 eraldiseisvat metaplastilist rakku ja/või
- üks silinderepiteeli kogumik, mille struktuuri on võimalik hinnata (Solomon ja Nayar 2004).
Materjali loetakse mitteadekvaatseks, kui proovis:
- esineb vähe portsio materjali ehk vähem kui 8000–12000 lameepiteeli rakku;
- on palju neutrofiile ja/või erütrotsüüte, mis katavad epiteeli rakke nii, et neid on võimatu adekvaatselt hinnata;
- materjal on puudulikult fikseerunud, mille tagajärjel ei ole rakud värvunud ning neid on võimatu hinnata;
- esineb artefakt (kinnaste talk, UH-anduri geel), mis katavad enamiku materjalist ning seda on võimatu adekvaatselt hinnata.
Materjali mitteadekvaatseks tunnistamisel tuleb olla äärmiselt ettevaatlik, sest selle põhjuseks võib olla veritsev pahaloomuline protsess. Bethesda süsteemi järgi ei tohiks materjali hinnata mitteadekvaatseks, kui proovis esineb vähemalt üks atüüpiline rakk. Sellistel juhtudel loetakse materjal adekvaatseks ning hinnatakse proovi atüüpilisi muutuseid (Solomon ja Nayar 2004). Seega tuleb mitteadekvaatsete proovidega olla tähelepanelik, eriti üksikute võimalike atüüpiliste rakkude suhtes. Nende leidmisel tuleks konsulteerida arst-tsütoloogiga või patoloogiga (Tamm 2009).
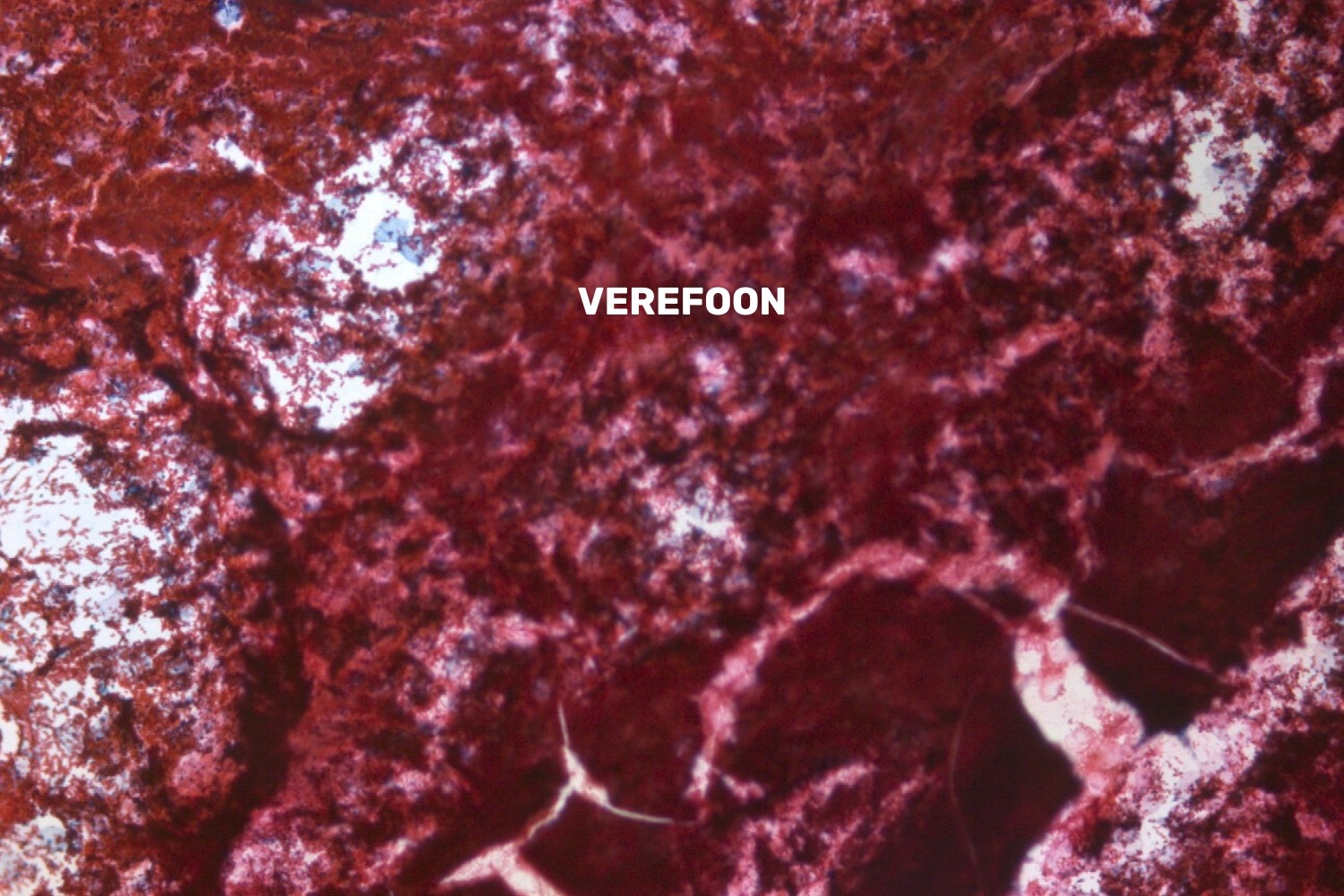
Preparaate, milles on verine foon, tuleks lugeda piiratud adekvaatsusega materjaliks, sest rohke veri segab hindamist (joon 47) ning tuleb olla eriti tähelepanelik atüüpiliste rakkude suhtes. Verise fooni põhjuseks võib olla:
- tsüklifaasi lõpp;
- raseduspatoloogia;
- äigematerjali võtmisel põhjustatud trauma;
- düsfunktsionaalne endomeetrium;
- emakakaela/emaka põletikulised protsessid;
- pahaloomulised protsessid.
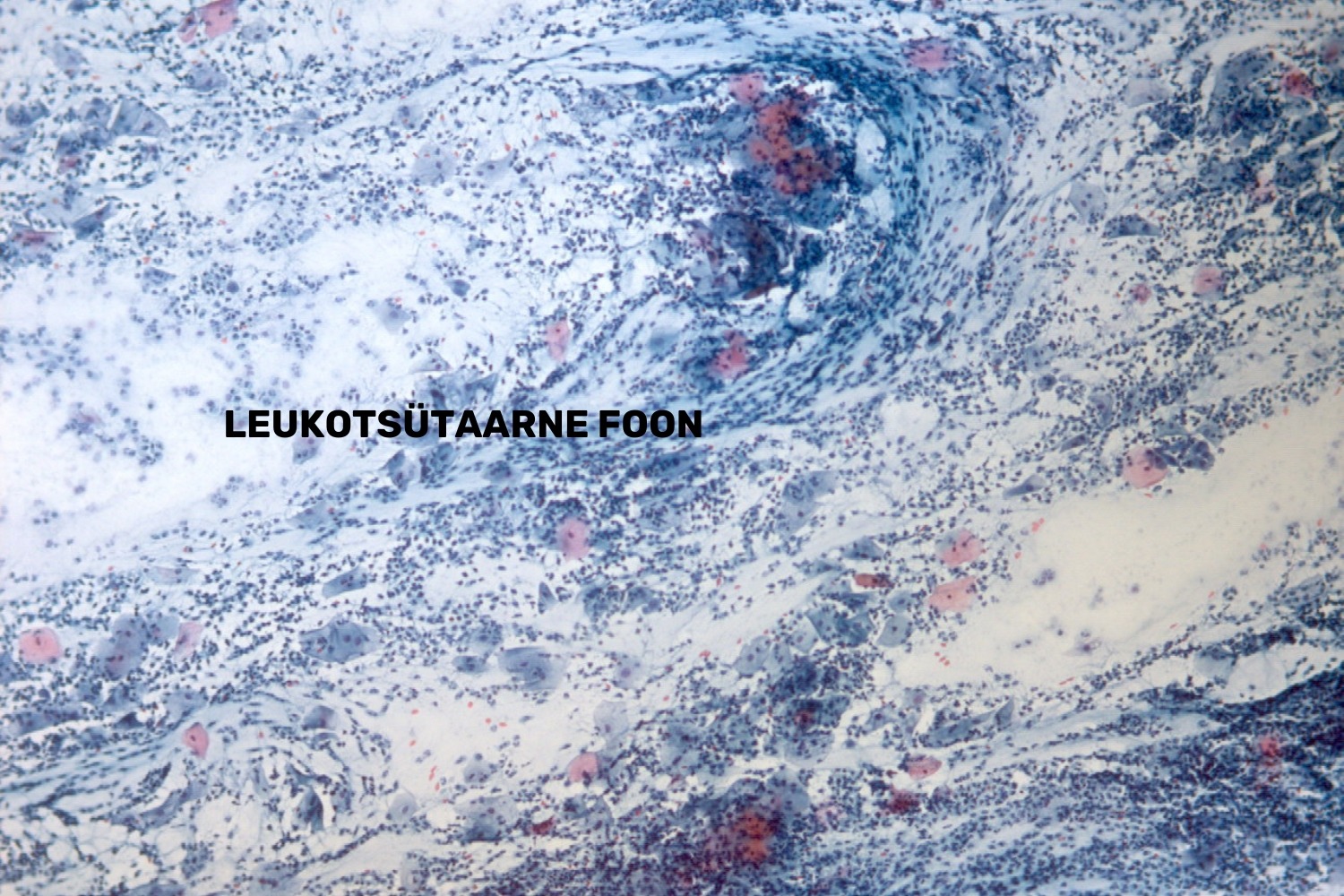
Leukotsütaarse fooniga preparaadid loetakse mitteadekvaatseks kui leukotsüüdid segavad adekvaatset hindamist (joon 48). Leukotsütaarse fooni põhjuseks võivad olla:
- haavandilised protsessid;
- kasvajad;
- hormonaalsed muutused;
- infektsioonid (Tamm 2009).
Taolistel juhtudel on vaja pärast põletikuvastast ravi viia läbi korduv PAP-test (Prilepskaja 1999).
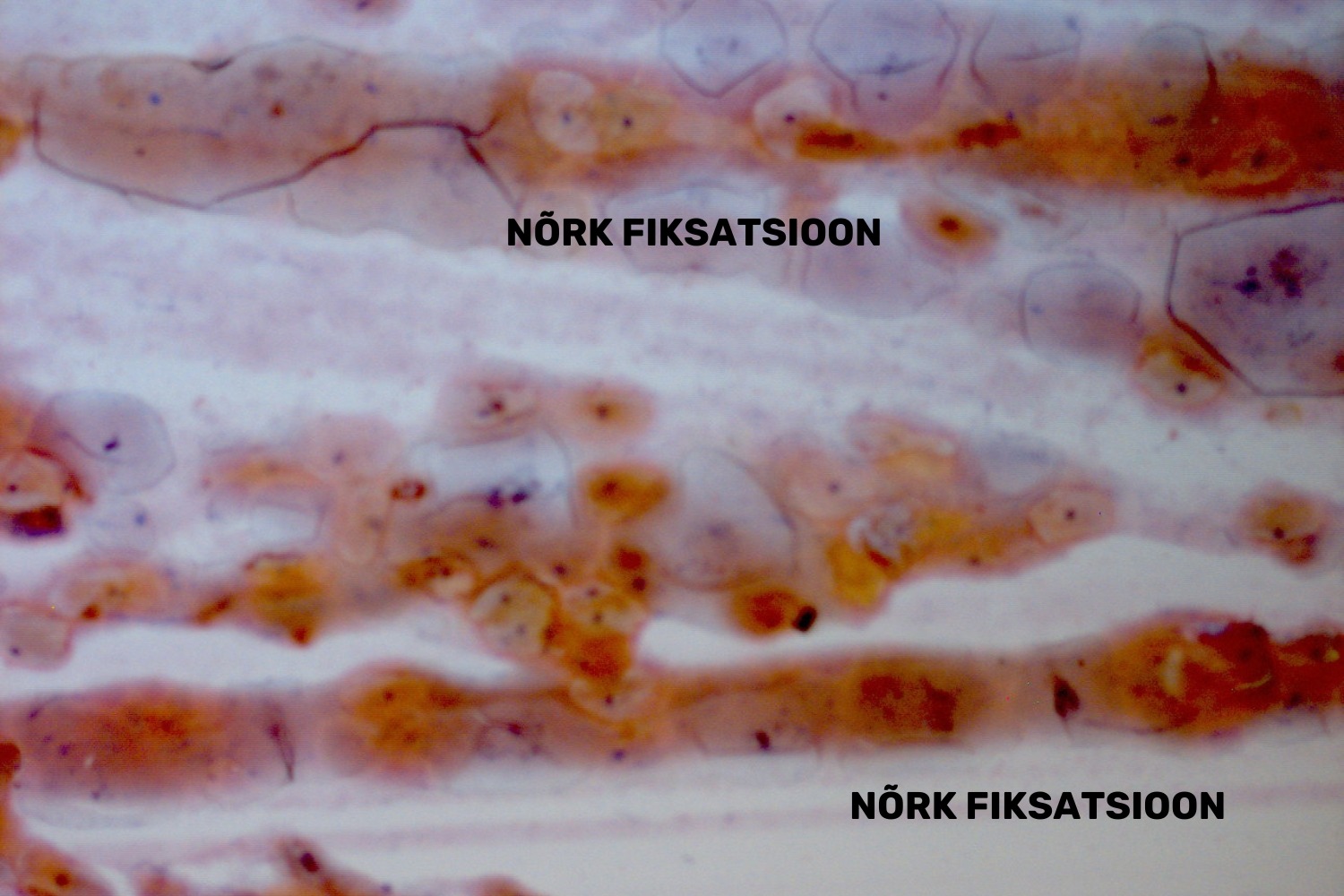
Levinuimaks veaks PAP-testi preanalüütilises etapis on nõrk fiksatsioon (joon 49). See võib tekkida nii 96%-lises etanoolis fikseerimise kui ka spetsiaalse aerosooli kasutamise korral. Vigade põhjuseks etanoolis fikseerimise korral võib olla lühiaegne fikseerimine (vähem kui 30 minutit) või lahjema kui 96%-lise etanooli kasutamine fikseerimisel. Peamiseks veaks aerosooliga fikseerimisel on preparaadi kuivamine enne fikseerimist.
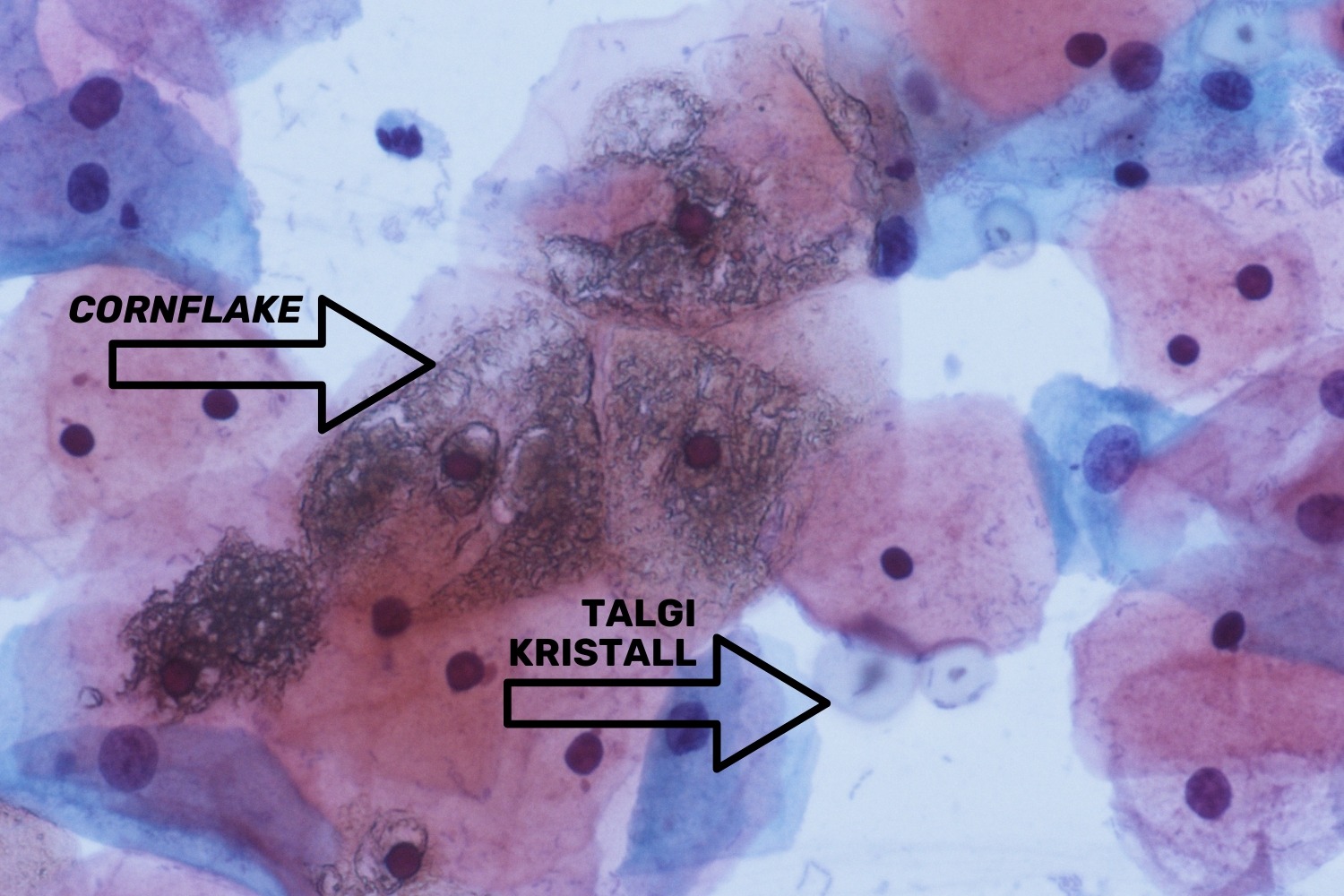
Artefaktidest kohtab kõige sagedamini talgikristalle ja nn „maisihelbeidˮ ehk cornflake. Talgikristallid satuvad klaasile kummikinnaste kasutamisel. Cornflake-efekti põhjustab materjali liigne kuivus enne preparaadi katmist palsami ja katteklaasiga. Cornflake-efekt väljendub preparaadis pruunide kristallidena lameepiteel rakkude peal (joon 50). Võib esineda ka ebaühtlase materjali korral, kui kuskil preparaadil on väga palju suurem hulk materjali, mistõttu kattepalsamit jääb väheseks.
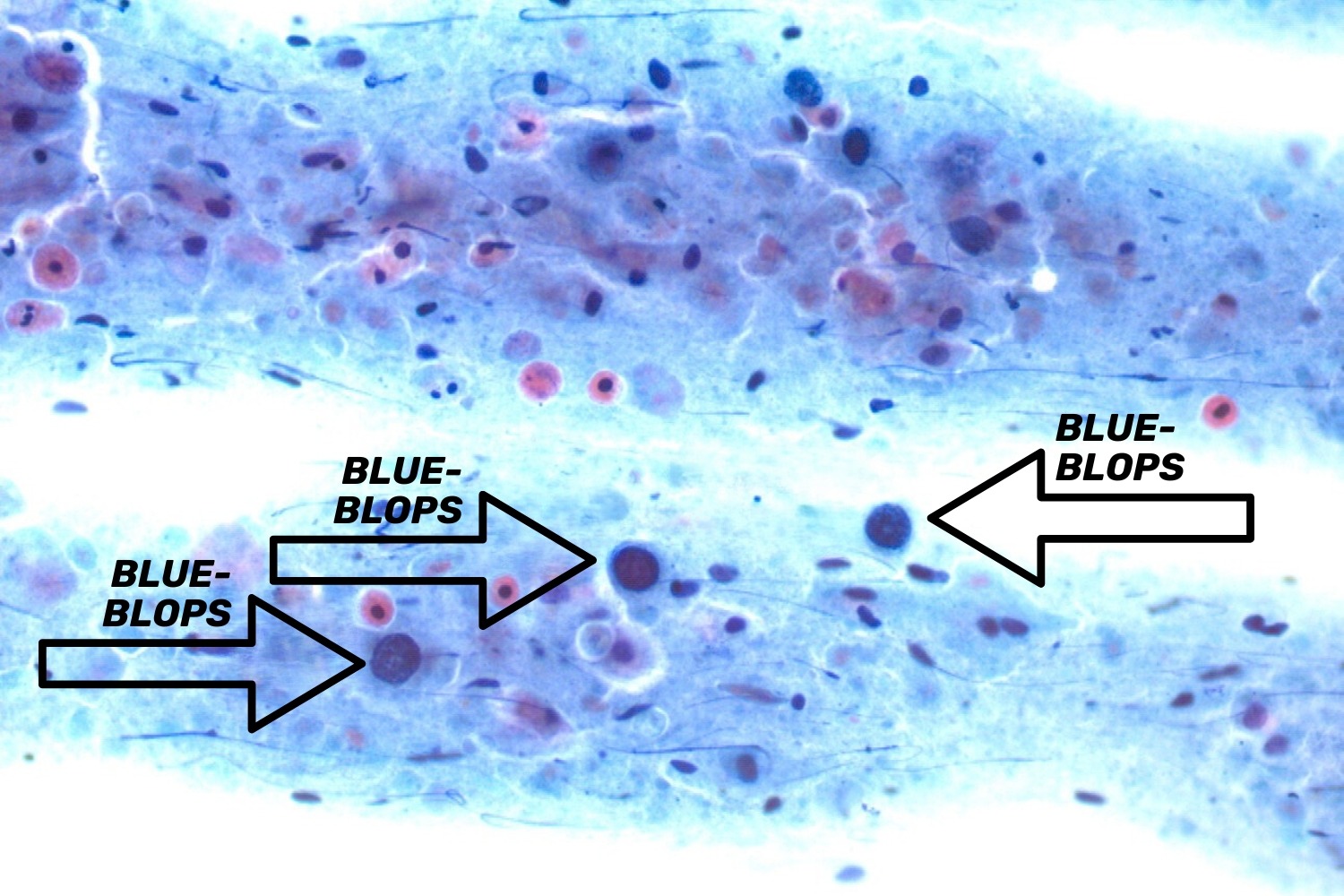
Atroofilise vaginiidiga patsientidel on vahel näha pildil suuri tumedaid ümmargusi limakogumikke, mida kirjanduses nimetatakse blue-blobs. Neid kerakujulisi moodustusi võib ekslikult tõlgendada düsplaasiaks, kuna need näevad välja nagu suurenenud hüperkroomsed paljad lameepiteeli tuumad (joon 51).
Mõisted
KASUTATUD ALLIKAD
Avwioro, O., Olabiyi, O., Avwioro, T. (2010). Sensitivity of a papanicolaou smear in the diagnosis of candida albicans infection of the cervix. North American Journal of Medical Sciences, 2(2): 97‒99.
Bertolini, R., Leutert, G. (1982). Atlas der Anatomie des Menschen. Leipzig.
Bethesda system website atlas http://nih.techriver.net/
Bowden, F.J., Garnett, G.P. (2000). Trichomonas vaginalis epidemiology: parameterising and analysing a model of treatment interventions. Sexually Transmitted Infections, 76: 248‒256.
Brotman, R. (2011).Vaginal microbiome and sexually transmitted infections: an epidemiologic perspective. The Journal of Clinical Investigation, 121(12): 4610‒4617.
Clarke, M., Rodriguez, A.,Gage1, J., Herrero,R., Hildesheim,A., Wacholder, S., Burk,R., Schiffman, M. (2012). A large, population-based study of age-related associations between vaginal pH and human papillomavirus infection. BMC Infectious Diseases 2012, 12: 33. http://www.biomedcentral.com/1471-2334/12/33 (21.12.13).
Coleman, DV., Dina, R., Capitanio, A., Domagala, W., Chosia, M., Olszewski, W. (2005). Eurocytology website, cervical cytology. http://www.eurocytology.eu/static/eurocytology/ENG/TP1CONTENT.html
Donders, G. (2007). Definition and classification of abnormal vaginal flora. Best Practice & Research Clinical Obstetrics and Gynaecology, Vol. 21 (3): 355‒373.
Güdücü, N., Gönenç, G., Işçi, H., Yiğiter, AB., Başsüllü, N., Dünder, I. (2012). Clinical importance of detection of bacterial vaginosis, trichomonas vaginalis, candida albicans and actinomyces in Papanicolaou smears. Clincal and experimental obstetrics & gynecology. 2012;39(3): 333‒6.
Hasteh, F. Cervix-Cytology. Inflammation/parasites. Herpes simplex virus (HSV). http://www.pathologyoutlines.com/topic/cervixcytologyHSV.html
Kaya, D., Demirezen, S., Hasçelik, G., Gьlmez Kivanç, D., Sinan Beksaç, M. (2013). Comparison of PCR, culturing and Pap smear microscopy for accurate diagnosis of genital. Actinomyces. Journal of Medial Microbiology, 62: 727‒733.
Mac DeMay, R. (2005). The Pap Test. By the American Socie for Clinical Patology.
Mandell, G. L., Bennett, J. E., Dolin, R. (2010). Principles and Practice of Infectious Diseases. Seventh edition. Philadelphia, USA, Churchill Livingstone Elsevier.
Roxby, A., Drake, A., John-Stewart, G., Brown, E., Matemo, D., Otieno, P., Farquhar, C.( 2011) Herpes simplex virus type 2, genital ulcers and HIV-1 disease progression in postpartum women. PLoS One. 2011; 6(5): e19947.
Solomon, D., Nayar, R. (2004). The Bethesda System for Reporting Cervical Cytology. Definitsions, Criteria, and Explanatory Notes. Springer.
Tamm, H. (2009). Sissejuhatus kliinilisse tsütoloogiasse. [Loengumaterjal]. http://www.hannpc.planet.ee/pdf/sissejuhatus.pdf (04.10.13).
Titmuss, E., Adams, C. (2009). Cervical Cytology. Conventional and Liquid Based. The Royal Society of Medicine Press Limited.
Прилепская. В.Н. (1999). Патология шейки матки и вульвы. Медпресс. Москва