2.4 CLOSTRIDIOIDES DIFFICILE LABORATOORSE TUVASTAMISE JUHEND
| Tartu Tervishoiu Kõrgkool Bioanalüütika labori kvaliteedikäsiraamat | ||
| Koostas: | Sander Kulli | Kuupäev 01.02.2022 |
| Kinnitas: | Marika Külm | Kuupäev 01.02.2022 |
2.4.1. MEETODI ULATUS
Juhend on mõeldud Clostridioides difficile määramiseks Tartu Tervishoiu Kõrgkooli mikrobioloogia õppelaboris.
2.4.2. MEETODI KEHTIVUS
Meetod kehtib kasutamiseks õppetöös: JAH
Meetod kehtib kasutamiseks teadusuuringute teostamisel: JAH
Meetod kehtib kliiniliseks kasutamiseks patsiendi proovide teostamisel: EI
2.4.3. ANALÜÜSI EESMÄRK
Clostridioides difficile on endospoore moodustav Grampositiivne anaeroobne pulgakujuline bakter, mida leidub inimeste normaalses mikroflooras 1–3% kuni 2–8% tervetel täiskasvanutel ning 15-20% imikutel (Goudarzi jt 2014, R-Biopharm AG i.a). C. difficile patogeensed tüved produtseerivad kaht toksiini, millest toksiin A on enterotoksiin ja toksiin B on tsütotoksiin (Gateau jt 2017). Antibiootikumiraviga seotud kõhulahtisuse kõige olulisemad tekitajad on C. difficile toksiine produtseerivad tüved (Terrier jt 2014). Nakatunud inimeste sümptomid ulatuvad kergest kõhulahtisusest kuni pseudomembranoosse koliidi, toksilise megakooloni või surmani (Laboratory procedures…2018). Juhendi eesmärgiks on Clostridioides difficile patogeense tüve tuvastamine mikrobioloogialaboris.
2.4.4. TÖÖOHUTUS

Laboris töötamisel järgi kõrgkoolis kehtivat „Laboris töötamise ohutuseeskirja“. Töö alustamisel ja lõpetamisel puhasta ning desinfitseeri tööpinnad. Proovide saabumisel laborisse käitle neid kinnastes ja ettevaatusega kui bioloogilise ohu allikaid. Esmakülvide tegemisel kasuta ühekordseid kindaid, mis peale töö sooritamist pane bioloogilise ohu kollasesse prügikotti enne, kui asetad külvid termostaati. Kiirtestid ja külv tee laminaarkapi all. Enne laminaarkapiga töötamist kontrolli selle toimivust. Laminaarkapi pindadele sattunud aineid eemalda ja desinfitseeri pinnad koheselt. Väldi reagentide kokkupuudet naha ja limaskestadega. Töö tegemise järgselt puhasta töövahendid. Testide tegemisel järgi rangelt kasutusjuhendit. Kõikide mikrobioloogiliste tööde sooritamisel pea kinni aseptika reeglitest.
2.4.5. PROOVIMATERJALI SÄILITAMINE
| Proovinõu | Materjal | Säilitamine |
Steriilne proovitops  | Roe | Temperatuur: 2° kuni 8°C, säilitamise aeg: ≤72 tundi. Temperatuur: -20° C, säilitamise aeg: >72 tundi. Temperatuur toksiini analüüsiks: 4°C, säilitamiseaeg: ≤72 tundi. Väldi proovi korduvat külmutamist ja sulatamist. |
2.4.6. ETTEVALMISTUSED
Testid on ainult in vitro diagnostiliseks kasutamiseks
Enne töö teostamist loe hoolikalt kasutusjuhendit
Enne kasutamist veendu, et proovid ja reagendid on toatemperatuuril
Ava kassetid vahetult enne kasutamist
Teste ei tohi läbi viia otseses päikesevalguses
Valmista ette statiiv, millel saab reaktsiooniviaale hoida vertikaalses asendis
2.4.7. ESIMENE UURINGUPÄEV
2.4.7.1. Clostridioides difficile spetsiifilise glutamaadi dehüdrogenaasi (GDH) määramine
Rida Quick Clostridium difficile GDH (glutamaat dehüdrogenaas) on immunokromatograafiline kiirtest, millega määratakse C. difficile spetsiifilist GDH ensüümi. Clostridioides difficile infektsiooni (CDI) kinnitamiseks on vajalik lisaks määrata C. difficile toksiinid A ja B. Kiirtesti reagentides sisalduvad GDH vastased antikehad. Kui proovimaterjalis on GDH (antigeen), moodustab see immuunkompleksi GDH vastaste antikehadega ning kompleks liigub mööda kassetis olevat membraani test- (T) ja kontrolljoonele (C). Testjoonele on kinnitatud immuunkompleksi kinni püüdvad ja nähtavaks tegevad ühendid (streptavidiin ja biotiin). GDH ja antikehade immunkompleksi tekkimine avaldub testjoonel punakasvioletse joonena (testi tulemus on positiivne). Kontrolljoonel (C) tekib punakasvioletne joon nii GDH ensüümi puudumise kui esinemise korral. Punakasvioletse joone puudumine testjoonel näitab, et testi tulemus on negatiivne, st proovimaterjalis puudub C. difficile.
Tööks vajalikud vahendid
- Vorteks segaja
- Statiiv
- Taimer
- 10 µl külviaasad
- RIDA QUICK Clostridium difficile GDH komplekt, kontrolli testide kvaliteeti – enne proovimaterjali sisestamist peavad testi kassetid olema kahjustusteta ja värviliste joonteta, reagentide ja testide säilivusaeg ei ole möödunud, reagendid ei ole kontamineerunud
Töö käik
- Pane 12-14 tilka reagenti A (joonis 2) mikrokatsutisse (joonis 3) kuni märgistuseni 0,5 ml.
- Pane 12-14 tilka reagenti B (joonis 2) samasse mikrokatsutisse kuni märgistuseni 1,0 ml.
- Reagendid A ja B tuleb segada suhtes 1:1. Kontamineerumise vältimiseks reagenti originaalpudelisse tagasi ei panda


- Vedela rooja korral: kasutades ühekordset pipetti, lisa 50 µl väljaheiteproovi reagentide A ja B segule
- Pooltahke rooja korral: kasutades 10 µl külviaasa, lisa 50 mg väljaheiteproovi reagentide A ja B segule
- Sule mikrokatsuti korralikult ning sega, kasutades Vortex-segajat
- Jäta settima 5 minutiks toatemperatuuril, et tekiks osakestest vaba supernatant
- Eemalda kassett ümbrisest ja aseta tasasele pinnale. Iga kassett on mõeldud ainult ühekordseks kasutamiseks
- Ühenda pipetiotsik mikropipetiga (joonis 4) ja pipeteeri 150 µl supernatanti testikasseti proovisisestusalale. Veendu, et vedelik voolab vabalt membraani mööda
- Hinda tulemust 15 minuti jooksul. Kontrolljoon (C) peab ilmuma umbes 3 minuti jooksul
- Tulemused:
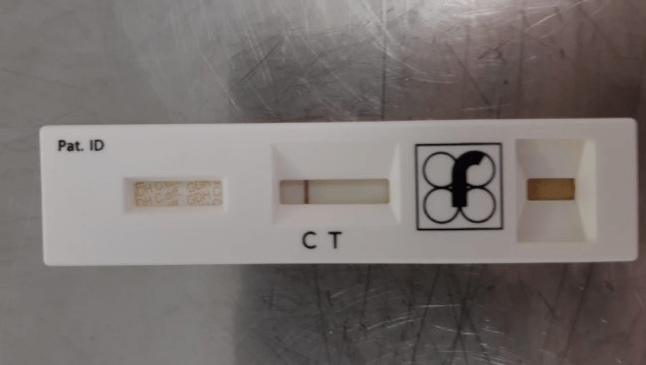
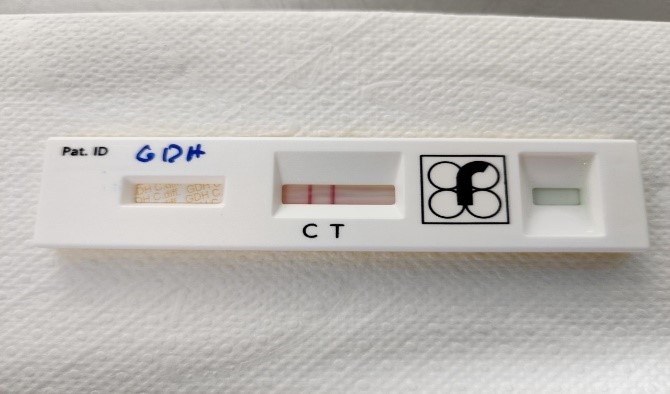
- C. difficile GDH positiivne: punakasvioletne värvus on nähtaval testjoonel ja kontrolljoonel (joonis 6)
- C. difficile GDH negatiivne: punakasvioletne värvus on nähtav ainult kontrolljoonel (joonis 5)
- Test on kehtetu kui:
- kontrolljoonele ei ole ilmunud punakasvioletset joont (ka siis, kui testjoonel on punakasvioletne joon olemas, joonis 7)
- kontroll- ja testjoonele ei ole ilmunud punakasvioletset värvust
- ilmunud on rohkem kui kaks joont
- punakasvioletsed jooned ilmuvad palju hiljem kui 15 minuti möödumisel proovimaterjali sisestamisest
- Kui kontrolljoonele punakasvioletset joont ei ole ilmunud, tuleb testi korrata. Kordamisel tuleb proovi paremini setitada (võimalusel tsentrifuugida seda 2000 g juures 2 minutit) ning pipeteerida uuele testkassetile. Joonte värvus võib muutuda punakasvioletsest sinakasvioletseks ja hallikasvioletseks
- Liigne proovimaterjali kogus võib tekitada testribale pruunid plekid, mis võib tulemuste lugemist segada. Sel juhul tuleb uurimiseks võtta väiksem proovimaterjali kogus või väljaheitesuspensiooni tugevamalt tsentrifuugida
- C. difficile GDH positiivse tulemuse korral tehakse C. difficile toksiinide A ja B kiirtest bakteri toksiine moodustava patogeense tüve kinnitamiseks
2.4.7.2. Clostridioides difficile toksiinide A ja B määramine
Rida Quick Clostridium difficile Toxin A/B on immuunkromatograafiline kiirtest, millega määratakse C. difficile A ja B toksiinid. Kiirtesti reagentides sisalduvad toksiini A ja toksiini B vastased antikehad. Toksiinide esinemisel proovimaterjalis moodustuvad toksiinide ja nende vastaste antikehade vahel immuunkompleksid, mis liiguvad mööda kassetis olevat membraani test- (T) ja kontrolljoonele (C). Testjoonele on kinnitatud immuunkompleksi kinni püüdvad ja nähtavaks tegevad ühendid (streptavidiin ja biotiin). Toksiini A ja toksiini B ning neile vastavate antikehade immuunkomplekside tekkimine avaldub testjoonel punakasvioletse joonena (testi tulemus on positiivne). Kontrolljoonel (C) tekib punakasvioletne joon nii toksiinide puudumise kui esinemise korral. Punakasvioletse joone puudumine testjoonel näitab, et testi tulemus on negatiivne – proovimaterjalis puuduvad C. difficile toksiinid A ja B.
Tööks vajalikud vahendid
- Vortex-segaja
- Taimer
- 10 µl aasad
- Statiiv
- RIDA QUICK Clostridium difficile ToxA/B, kontrolli testide kvaliteeti – testi kassetid peavad olema kahjustusteta, värviliste joonteta enne proovimaterjali sisestamist, reagentide ja testide säilivusaeg ei ole möödunud, reagendid ei ole kontamineerunud
Töö käik
- Pane 12-14 tilka reagenti A mikrokatsutisse kuni märgistuseni 0,5 ml
- Pane 12-14 tilka reagenti B samasse mikrokatsutisse kuni märgistuseni 1,0 ml
- Reagendid A ja B tuleb segada suhtes 1:1. Kontamineerumise vältimiseks reagenti originaalpudelisse tagasi ei panda
- Vedela rooja korral: kasutades ühekordset pipetti, lisa 50 µl väljaheiteproovi reagentide A ja B segule
- Pooltahke rooja korral: kasutades 10 µl külviaasa, lisa 50 mg väljaheiteproovi reagentide A ja B segule
- Bakterite vedelkultuuri korral: pipeteeri 50 µl kultuuri ja lisa reagentide A ja B segule
- Bakterite tahke kultuuri korral: valmista C. difficile kolooniatest suspensioon, selleks võta võimalikult palju kolooniaid ning suspendeeri need 1 ml füsioloogilises lahuses või destilleeritud vees. Lisa 50 µl suspensiooni reagentide A ja B segule
- Sule mikrokatsuti korralikult ning sega, kasutades Vortex-segajat
- Jäta settima 5 minutiks toatemperatuuril, et osakestest tekiks vaba supernatant
- Eemalda kassett ümbrisest ja aseta tasasele pinnale. Iga kassett on mõeldud ainult ühekordseks kasutamiseks
- Ühenda pipetiotsik mikropipetiga ja pipeteeri 150 µl supernatanti testikasseti proovisisestusalale. Veendu, et vedelik liigub vabalt membraani mööda
- Hinda tulemust 15 minuti pärast. Kontrolljoon (C) peab ilmuma umbes 3 minuti jooksul.
- Tulemused:
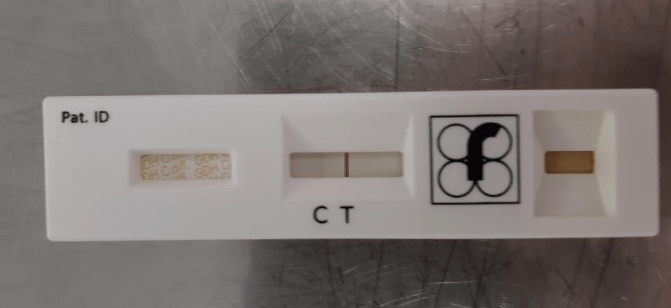
- C. difficile toksiinid positiivne: punakasvioletne värvus on nähtaval testjoonel ja kontrolljoonel (joonis 6)
- C. difficile toksiinid negatiivne: punakasvioletne värvus on nähtav ainult kontrolljoonel (joonis 5)
- Test on kehtetu kui:
- kontrolljoonele ei ole ilmunud punakasvioletset joont (ka siis, kui testjoonel on punakasvioletne joon olemas, joonis 7)
- kontroll- ja testjoonele ei ole ilmunud punakasvioletset värvust
- ilmunud on rohkem kui kaks joont
- punakasvioletsed jooned ilmuvad palju hiljem kui 15 minuti möödumisel proovimaterjali sisestamisest
- Kui kontrolljoonele punakasvioletset joont ei ole ilmunud, tuleb testi korrata. Kordamisel tuleb proovi paremini setitada (võimalusel tsentrifuugida seda 2000 g juures 2 minutit) ning pipeteerida uuele testkassetile. Joonte värvus võib muutuda punakasvioletsest sinakasvioletseks ja hallikasvioletseks
- Liigne proovimaterjali kogus võib tekitada testribale pruunid plekid, mis võib tulemuste lugemist segada. Sel juhul tuleb uurimiseks võtta väiksem proovimaterjali kogus või väljaheitesuspensiooni tugevamalt tsentrifuugida
2.4.7.3. Kiirtestide tulemuste interpreteerimine
Rida Quick Clostridium difficile GDH testi negatiivne tulemus välistab C. difficile nakkuse. Positiivse tulemuse korral on vaja patogeense C. difficile tüve esinemine kinnitada Rida Quick Clostridium difficile Toxin A/B testiga. GDH testi positiivse tulemuse korral, kuid toksiinide negatiivse tulemuse korral on uuring C. difficile suhtes positiivne, kuid vabu toksiine ei leidu, mis viitab kolonisatsioonile toksilise või mittetoksilise tüvega. GDH testi positiivse tulemuse korral, ning toksiinide positiivse tulemuse korral on uuring C. difficile suhtes positiivne, mis viitab C. difficile infektsioonile. Mõlema testi tulemust tuleb alati tõlgendada koos kliiniliste sümptomitega. Positiivne tulemus ei välista teisi nakkustekitajaid. Negatiivne tulemus ei välista C. difficile infektsiooni olemasolu. Tulemus võib olla negatiivne patogeeni vahelduva eritumise tõttu roojasse või seetõttu, et toksiinide või GDH kontsentratsioon proovis on alla avastamispiiri.
2.4.7.4. Clostridioides difficile külv
Clostridioides difficile isoleeritakse antibiootikumtundlikkuse määramiseks, genotüpiseerimiseks või laboratoorse tuvastamise ühe etapina. C. difficile kasvamine selektiivsel söötmel on samaväärne GDH testi positiivse tulemusega, seega saab bakteri isoleerimist koos toksiini määramisega kasutada C. difficile patogeense tüve laboratoorseks diagnoosimiseks. C. difficile isoleerimiseks ja samastamiseks sümptomaatiliste patsientide roojast kasutatakse selektiivset ja kromogeeset ChromID C. difficile agarit. ChromID agar sisaldab erinevaid peptoone, taurokolaate endospooride idanemise soodustamiseks, lisaks kromogeenseid substraate ja antibiootikumide segu, mis võimaldavad isoleerida ja samastada ß-glükosidaasi produtseerivaid C. difficile tüvesid ning inhibeerida teiste mikroorganismide kasvu.
Ettevalmistused
Soojenda agarid enne külvamist toatemperatuurini
Hinda chromID kvaliteeti – agar ei tohi olla kontamineerunud, krobelise pinnaga, kuivanud või liigse kondensveega
Vahendid ei tohi olla ületanud säilivusaega
Seadista termostaat temperatuurini 37 °C
Inokuleeri ainult vedelat või pooltahket rooja sümtomaatiliselt patsiendilt
Tööks vajalikud vahendid
- Proovimaterjal
- Veekindel marker
- ChromID agar
- 10 µl külviaasad
- BD GasPak EZ Pouch System või ANOXOMAT seade
- Termostaat
Töö käik
- Markeeri ChromID agar kuupäeva, proovinumbri ning oma nimega
- Ava proovitops
- Võta 10 μl külviaasaga rooja proovi
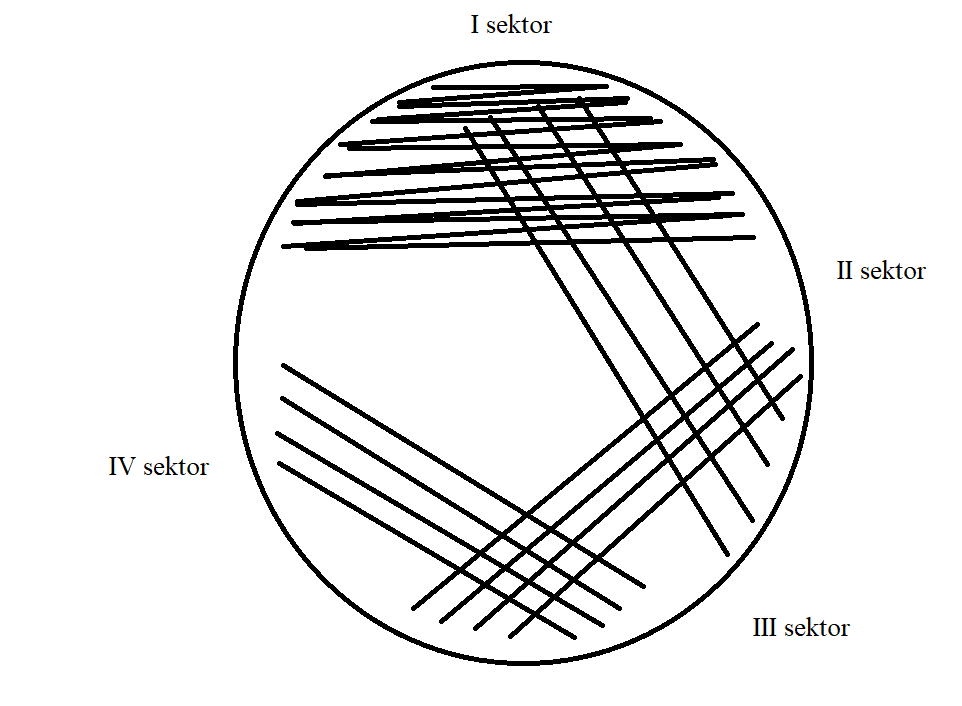
- Tee poolkvantitatiivne külv (joonis 8), toimi järgmiselt:
- Kanna materjal ühele kolmandikule Petri tassil olevale agarile (joonis 8 I sektor)
- Võta uus steriilne külviaas, puuduta I sektorit ja tõmba neli paralleelset joont vasakult paremale (joonis 8 II sektor)
- Keera tassi, vaheta külviaasa pool, puuduta II sektorit ja tõmba neli paralleelset joont vasakult paremale (joonis 8 III sektor)
- Keera tassi, võta uus steriilne külviaas, puuduta III sektorit ja tõmba neli paralleelset joont vasakult paremale (joonis 8 IV sektor)
- Aseta külvatud tassid anaeroobsesse keskkonda 15-20 minuti jooksul.
2.4.7.5. Kasvukeskkonna loomine
Anaeroobide inkubeerimiseks kasutatakse laborites anaeroobseid purke, karpe, kotte või kambreid. BD GasPak™ EZ Gas Generating Pouch Systems sisaldab vahendeid anaeroobse, mikroaerofiilse või kapnofiilse keskkonna loomiseks. Bakterite kasvuks sobiva gaasilise keskkonna tekitavad spetsiaalsed ümbrikud, mis sisaldavad anorgaanilist karbonaati, aktiivsütt, askorbiinhapet ja vett. Ümbrik eemaldatakse plastikfooliumkattest, õhuga kokkupuutel selles sisalduvad ained aktiveeritakse. Aktiveeritud ainetega ümbrik asetatakse koos inokuleeritud Petri tassidega spetsiaalsesse plastkotti, mis suletakse õhukindlalt. Ümbrikus olevad ained aktiveeritakse õhuga kokkupuutel, mille tulemusel need ained vähendavad suletud plastkotis kiiresti hapniku kontsentratsiooni ja samal ajal tekib CO2. BD GasPak EZ Anaerobe Pouch System with Indicator tekitab anaeroobse keskkonna 2,5 tunni möödumisel plastkoti sulgemisest, kusjuures CO2 saavutab ≥10% kontsentratsiooni 24 tunni jooksul. Inkubeerimise algusest 30 minuti vältel ilmub plastkotti kondensaat ja anaerobioosi indikaator omandab 2-4 tunni jooksul temperatuuril 35 °C valge värvuse. BD GasPak™ EZ Gas Generating Pouch Systems kasutatakse ainult in vitro diagnostikaks ning GasPak ümbrikuid kasutatakse ainult GasPak plastkottides. Kahjustunud või avatud plastikfooliumiga ümbrikud ning plastikotid tuleb uuringust eemaldada, vältida tuleb otsest päikesevalgust ning kõrget temperatuuri. Bakterite kasvuks sobiva gaasilise keskkonna loomiseks tuleb ümbrikud avada vahetult enne kasutamist ning ei tohi kasutada, kui indikaatori värv on sinine. Ümbriku indikaatorit ei tohi puudutada ning eemaldada pakendist. Kotte ei avata enne inkubeerimise lõppu. Pärast kasutamist visata kott bioloogilise ohu märgistusega jäätmenõusse.
Alternatiivselt võib sobiva gaasilise keskkonna tekitada kasutades selleks ANOXOMAT seadet ja sellele sobivaid Petri tasside mahuteid. Mahutid suletakse koheselt peale Petri tasside asetamist neisse, ühendatakse ANOXOMAT seadmega, valitakse sobiv gaasiline keskkond ja täidetakse. Seejärel paigutatakse mahutid termostaati.
Töö käik
- Aseta 1-4 Petri tassi spetsiaalsesse plastikkotti
- Eemalda anaeroobset keskkonda tekitav ümbrik koos indikaatoriga plastikfooliumist
- Aseta ümbrik koos indikaatoriga plastkotti tasside vahele
- Lukusta plastikkoti riiv ning veendu, et plastikkott oleks õhukindlalt kinni
- Alternatiivselt kasuta ANOXOMAT seadet
- Inkubeeri 37°C termostaadis 24 tundi
2.4.8. TEINE UURINGUPÄEV
2.4.8.1. Tulemused ja kasvu hindamine agaril
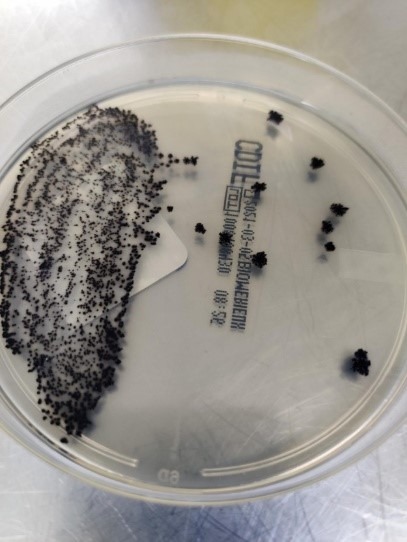
Pärast inkubeerimist ava plastikkott või ANOXOMAT seadmele sobiv mahuti, võta Petri tassid välja. Kui kasutasid plastkotti, siis aseta plastikkott ja ümbrik bioloogilise ohu märgistusega kotti. C. difficile kolooniad chromID söötmel on mustjashalli värvusega ja ebaregulaarsete või siledate piiridega (Joonis 9). Väljakasvanud kolooniad kasutatakse antibiootikumtundlikkuse määramiseks, genotüpiseerimiseks või C. difficile laboratoorse tuvastamise ühe etapina.
2.4.9. ÜLESANNE
Koostada CDI laboratoorse uuringu algoritm koos kvaliteedi kontrolli kirjeldusega.
MÄRKUS: Bakteri Clostridioides difficile uuringutes kasutatavate testide ja söötme nimetuses on veel kajastatud bakteri eelmine liiginimi Clostridium difficile, kuna kõikjal ei ole veel uuele liiginimele üleminek toimunud.