2.3 STAPHYLOCOCCUS SPP SAMASTAMISE JUHEND
| Tartu Tervishoiu Kõrgkool Bioanalüütika labori kvaliteedikäsiraamat | ||
| Koostas: | Carine Platonova | Kuupäev 01.03.2019 |
| Kinnitas: | Marika Külm, Triin Aasmäe | Kuupäev 01.03.2019 |
2.3.1. MEETODI ULATUS
Juhend on mõeldud Staphylococcus spp ja MRSA määramiseks Tartu Tervishoiu Kõrgkooli mikrobioloogia õppelaboris
2.3.2. MEETODI KEHTIVUS
Meetod kehtib kasutamiseks õppetöös: JAH
Meetod kehtib kasutamiseks teadusuuringute teostamisel: JAH
Meetod kehtib kliiniliseks kasutamiseks patsiendi proovide teostamisel: EI
2.3.3. ANALÜÜSI EESMÄRK
Juhendi eesmärgiks on Staphylococcus spp ja MRSA samastamine erinevatest materjalidest API testsüsteemide abil.
2.3.4. TÖÖOHUTUS
Laboris töötamisel tuleb järgida kõrgkoolis kehtivat „Laboris töötamise ohutuseeskirja“. Töö alustamisel ja lõpetamisel puhastatakse ning desinfitseeritakse tööpinnad. Proovide saabumisel laborisse käideldakse neid kinnastes ja ettevaatusega kui bioloogilise ohu allikaid. Esmakülvide tegemisel kasutatakse kindaid, mis peale töö sooritamist pannakse bioloogilise ohu kollasesse prügikotti enne, kui külvid asetatakse termostaati. Kõikide mikrobioloogiliste tööde tegemisel järgitakse aseptika reegleid.
Mikrobioloogia labor on tähistatud bioloogilise ohu märgiga (Joonis 1).

2.3.5. PROOVIMATERJALI VÕTMINE JA SÄILITAMINE
| Kogumisnõu | Materjal | Säilitamine |
| Steriilne proovitops/pudel | röga, mäda, ninaneelu loputusvedelik, veri | 30 minutit toatemperatuuril, 4 tundi 4 °C juures |
| Steriilne tampoon transportsöötmega | haava-, kõrva-, nina- ja urogenitaaltrakti eritised | 30 minutit toatemperatuuril, 4 tundi 4 °C juures |
Tabel 1. Materjalide säilitamine
2.3.6. ESIMENE UURINGUPÄEV
2.3.6.1 Vajalikud ettevalmistused
Enne külvamist peavad agarid soojenema toatemperatuurini
Hinnake veriagari (VA) ja mannitool soola agari (MSA) kvaliteeti – agarid ei tohi olla kontamineerunud ning ei tohi olla ületanud säilivusaega
Seadistage termostaat temperatuurini 37 °C
2.3.6.2 Tööks vajalikud vahendid
- Proovimaterjal ja veekindel marker
- Veri- (VA) ja mannitool soola (MSA) agarid
- 10 μl ja 1 μl külviaasad
- Termostaat
- Kollane erimärgistusega prügikott ja kollane erimärgistusega läbimatu konteiner teravatele ja lõikavatele vahenditele (näiteks alusklaasidele)
2.3.6.3 Esmaskülvid poolkvantitatiivse külvina agaritele
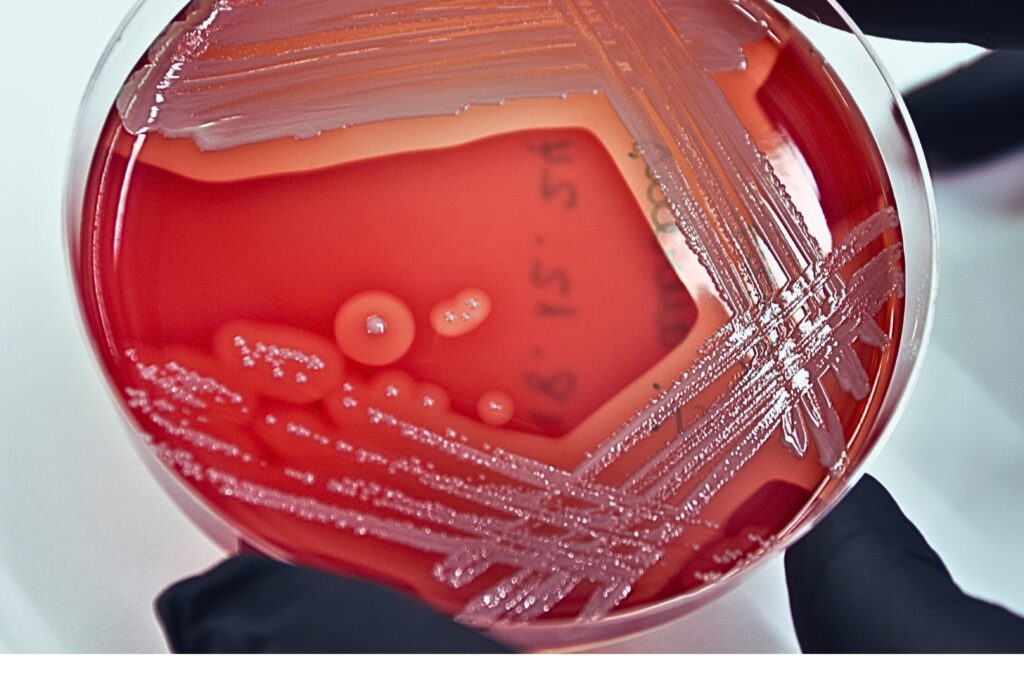
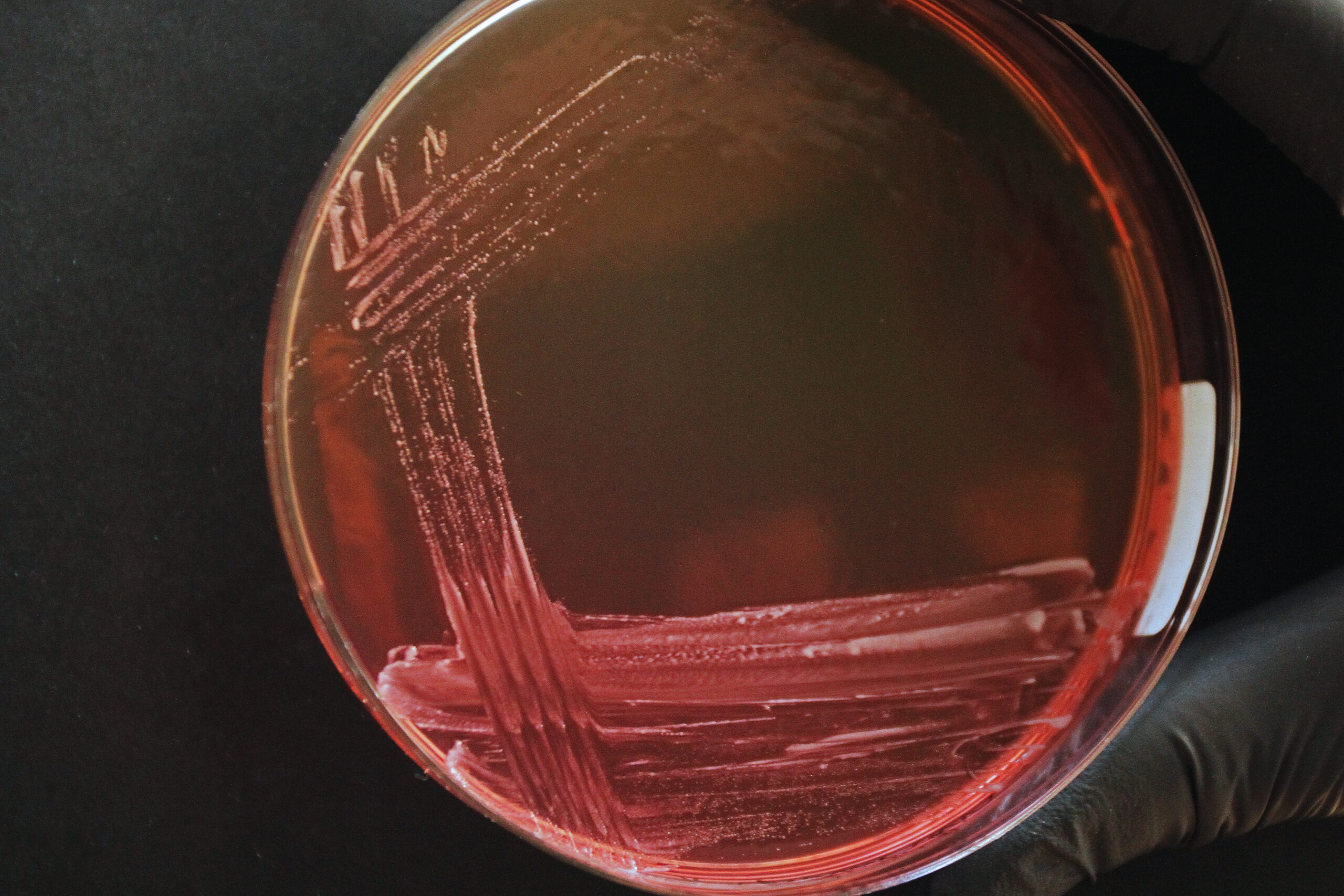
Veriagar (VA) on mittespetsiifiline sööde, millel kasvavad paljud mikroorganismid. Veri veriagari koostisosana võimaldab hinnata mikroobide hemolüüsi võimet. Pärast 18–24 tunnilist inkubeerimist võtke esmaskülvid termostaadist välja. VA’l on Staphylococcus spp kolooniad kumerad, värv varieerub valgest kuldkollaseni (Joonis 3), võib esineda β-hemolüüs (Joonis 4).
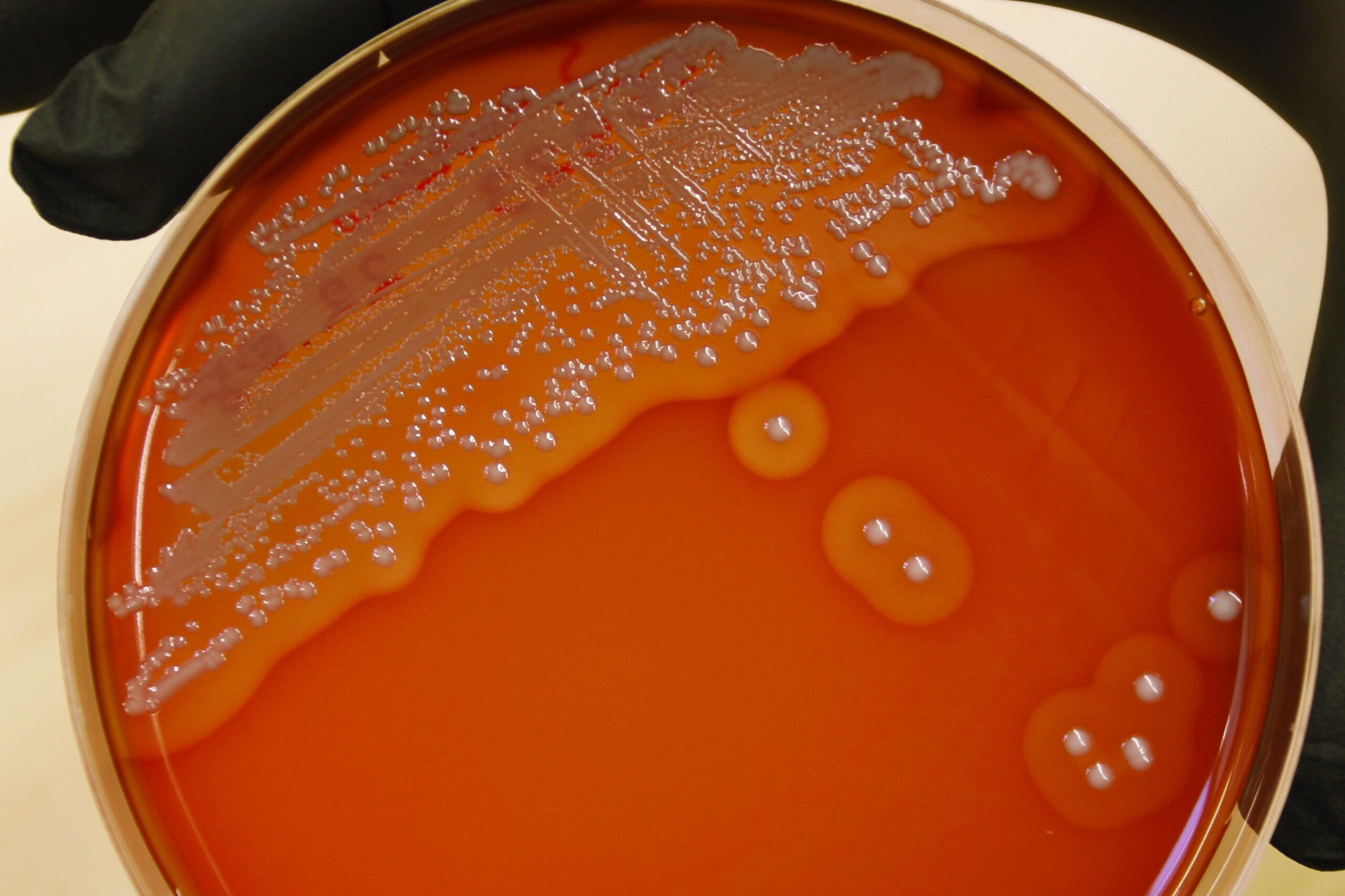
Mannitool soola agar (MSA) on selektiivne sööde, millel on võimelised kasvama naatriumkloriidi kõrgeid kontsentratsioone taluvad mikroorganismid. MSA’l on koagulaas-positiivsete stafülokokkide (näiteks S. aureus) pesad läbipaistmatud, kumerad, värv varieerub valgest kollaseni, inkubeerimise tulemusel muutub söötme värv kollaseks mannitooli lõhustamise tõttu (Joonis 5). Koagulaas-negatiivsete stafülokokkide (näiteks S. epidermidis) pesad on punakas-roosad, väikesed, inkubeerimisel jääb söötme värv punaseks (Joonis 6).
- Märgista VA ja MSA agarid kuupäeva, proovinumbri ning oma nimega.
- Ava proovinõu:
- tampooni puhul võta kontaminatsiooni vältimiseks ettevaatlikult tampoon proovinõust välja nii, et see ei puutuks proovinõu külge;
- proovitopsis oleva materjali puhul tuleb proovi enne külvamist ringjate liigutustega segada.
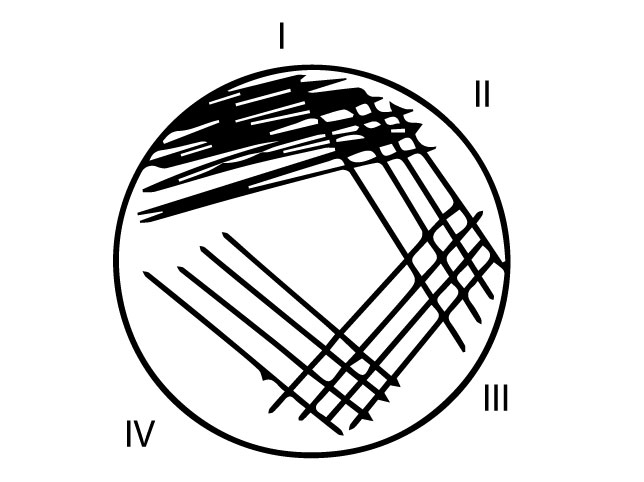
- Proovitopsis oleva materjali jaoks võta 10 μl külviaasatäis materjali ja kanna materjal edasi-tagasi liigutustega laiali ühe kolmandiku tassi pinnale (Joonis 2. I sektor).
- Tampooni korral kandke materjal edasi-tagasi liigutustega laiali ühe kolmandiku tassi pinnale (Joonis 2. I sektor).
- Kasutades uut steriilset külviaasa ja puudutades I sektorit, tõmba neli paralleelset joont vasakult paremale (Joonis 2. II sektor).
- Keera tassi, vaheta külviaasa poolt ning puudutades II sektorit tõmba neli paralleelset joont vasakult paremale (III sektor).
- Keera tassi, võta uus steriilne külviaas ning puudutades III sektorit tõmba neli paralleelset joont vasakult paremale (IV sektor).
- Kasutatud külviaasad ja kindad aseta kollasesse erimärgistusega prügikotti.
- Peale külvamist aseta agarid termostaati 37 °C juurde 18–24 tunniks.
2.3.7. TEINE UURINGUPÄEV
2.3.7.1 Esmaskülvide hindamine

2.3.7.2 Äigepreparaadi valmistamine
Vajalikud ettevalmistused
Kõik vajalikud vahendid paiguta lauale töö tegemiseks sobivasse järjekorda.
- Veriagar uuritava kultuuriga
- Alusklaas
- Steriilsed ühekordsed külviaasad
- Statiiv
- Tilgapudel destilleeritud veega
- Gaasipõleti või piirituslamp
- Pintsetid
- Marker
- Kollane erimärgistusega prügikott ja kollane erimärgistusega torkekindel konteiner teravatele ja lõikavatele vahenditele (nt alusklaasidele)
Äigepreparaadi tegemine
- Valmista äigepreparaat Grami värvingu tegemiseks kuni 24 tunni vanusest (so logaritmilises kasvufaasis olevast) bakterikultuurist.
- Märgista tassi põhjal markeriga pesa, mida soovid edasistes uuringutes kasutada. Pesa peaks olema võimalikult suur, et materjali jätkuks kõigi uuringute jaoks.
- Tilguta alusklaasile tilgapudelist väike tilk destilleeritud vett.
- Võta ühekordse külviaasaga uuritavast pesast väike kogus materjali ning suspendeeri see ca 1 cm diameetriga ringjate liigutustega destilleeritud vee tilgas. Preparaadi kvaliteet tuleb parem, kui võtad külviaasale võimalikult vähe materjali.
- Aseta kultuuriga külviaas kollasesse erimärgistusega prügikotti.
- Lase mikroobi suspensioonil õhu käes kuivada. Selle kiirendamiseks võib asetada alusklaasi termostaati 37 oC juurde või gaasipõleti leegi kõrvale, hoidudes kuumutamisest.
- Fikseeri preparaat leegis. Selleks võta alusklaas pintsettide vahele ning juhi see 2–3 korda üle gaasileegi, vältides preparaadi mõjutamist liigse kuumusega.
- Alternatiivselt võib preparaadi fikseerida metanoolis 30 sekundi jooksul.
- Mikroobidega kokku puutunud vahendid aseta kollasesse erimärgistusega prügikotti, teravad ning lõikavad vahendid kollasesse erimärgistusega läbimatusse konteinerisse.
2.3.7.3 Gram’i värving
Gram’i värvingu põhimõte
Bakterirakkude erinev värvumine tuleneb Grampositiivsete ja Gramnegatiivsete bakterite rakuseina erinevast ehitusest. Kristallvioleti vesilahus difundeerub rakku ja seondub bakterirakkude negatiivselt laetud osadega. Joodilahuse lisamisel tekivad bakterirakus suured kristallvioleti ja joodi kompleksid. Grampositiivsete bakterite rakuseinas olev paks peptidoglükaani kiht koos lipiididega takistab järgnevat dekoloreerimist. Gramnegatiivsete bakterite rakuseina peptodoglükaani kiht on õhuke, dekoloreeriva ainega töötlemisel muutub see kristallvioleti-joodi kompleksidele läbitavaks ja värv uhutakse rakust välja. Järgnevalt värvitakse baktereid järelvärvimisel (või vastandvärvimisel) safraniini või karboolfuksiiniga punaseks. Gramnegatiivsed bakterid, millest kristallviolett oli välja uhutud, värvuvad järelvärvimisel safraniini või karboolfuksiiniga punaseks. Grampositiivsete bakterite värvi safraniiniga või karboolfuksiiniga järelvärvimine ei mõjuta, nad värvuvad kristallvioletiga tumesiniseks või tumevioletseks. Pärmseened värvuvad nagu Grampositiivsed bakterid tumesiniseks või tumevioletseks ning on mikroskopeerimisel nähtavad suuremate rakkudena kui bakterid. Värvumine toimub õigesti, kui kasutatakse logaritmilises kasvufaasis olevaid rakke, mida üldjuhul saab 18-24 tunni vanusest bakterikultuurist.
Vajalikud ettevalmistused
Kõik vajalikud vahendid paiguta lauale töö tegemiseks sobivasse järjekorda.
- Uuritava kultuuriga äigepreparaat
- Steriilne ühekordne külviaas
- Gram’i värvinguks vajalikud reagendid – kristallvioleti lahus, Lygoli lahus, dekoloraator, karboolfuksiini või safraniini lahus
- Loputamiseks kolb kraaniveega
- Neerukauss
- Alus preparaadi hoidmiseks
- Preparaadi statiiv
- Pintsetid
- Filterpaber
- Taimer
- Kollane erimärgistusega prügikott ja kollane erimärgistusega torkekindel konteiner teravatele ja lõikavatele vahenditele (nt alusklaasidele)
Grami järgi värvimine
Kontrolli Grami värvide säilivusaega. Grami värvingu tegemisel tuleb järgida värvide tootja juhiseid ja vajadusel vastavaid toimimisaegu kohandada.
- Aseta äigepreparaat neerukausi kohal olevale preparaadi alusele
- Kata äigepreparaat kristallvioleti lahusega, hoia 1 minut
- Loputa äigepreparaati rohke veega, väldi vee valamist otse preparaadile
- Kanna äigepreparaadile Lygoli lahust, hoia 1 minut
- Loputa rohke veega
- Kanna äigepreparaadile dekoloreeriv lahus, hoia 20 sekundit
- Loputa rohke veega
- Kanna äigepreparaadile safraniini (või karboolfuksiini) lahus, hoia 1 minut
- Loputa rohke veega
- Aseta preparaat preparaadi statiivile ja lase kuivada õhu käes
- Mikroobidega kokku puutunud vahendid aseta kollasesse erimärgistusega prügikotti, teravad ning lõikavad vahendid kollasesse erimärgistusega läbimatusse konteinerisse
Mikroskopeerimine
- Kanna kuivanud preparaadile 1–2 tilka immersioonõli
- Mikroskopeerimiseks kasuta 100-kordse suurendusega õliimmersioonobjektiivi
- Hinda preparaadi kvaliteeti ja mikroobide suurust, värvust, kuju ja asetust
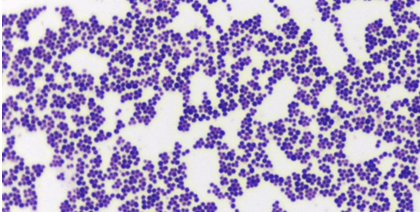
Staphylococcus spp on Gram-positiivsed kokid. Preparaadis paiknevad bakterid ebaregulaarsete, viinamarjakobarat meenutavate kogumikena (Joonis 7).
Võimalikud vead Grami järgi värvimisel
Sinise tooni varieeruvuse põhjused Grami järgi värvimismeetodi kasutamisel:
- Tehnilised vead nagu liiga paks preparaat (baktereid on alusklaasil liiga palju), liigne kuumutamine fikseerimisel, liigne dekoloreerimine, liigne dekoloreerimise järgne loputamine.
- Dekoloreerimise kestus peab olema täpne. Kui dekoloraatoriga töödelda liiga kaua, siis võib kristallvioleti välja uhuda ka Grampositiivsetest rakkudest ja need on peale safraniiniga (karboolfuksiiniga) värvimist punased. Kui aga dekoloreerimine toimub liiga lühikest aega, siis võivad ka Gramnegatiivsed bakterid hoida kristallvioletti kinni ja rakud on nähtavad violetsetena ehk tuvastatakse kui vale Grampositiivsed.
- Mõnikord on vaja koloriseerimise täpne aeg ise kindlaks teha, kuna tootja annab liiga suure vahemiku. Seda saab teha kontrollkultuure Grami järgi värvides.
Vale Gramnegatiivsed rakud:
- Grami järgi värvimisel kasutatakse noori (lag faasi) Grampositiivsete bakterite kultuure.
- Grami järgi värvimisel kasutatakse vanu (> 24 h) Grampositiivsed bakterid. Vanade kultuuride rakkudel väheneb kristallvioleti sidumise võime, mistõttu vanad Grampositiivsed rakud võivad reageerida värvidele kui Gramnegatiivsed rakud või anda erinevaid (mitteusaldusväärseid) tulemusi. Gramnegatiivsed rakud värvuvad vanusest sõltumata Gramnegatiivsetena.
- Proovimaterjali võtmisele on eelnenud patsiendi ravimine antibiootikumidega, mis pärsivad bakterite rakuseinas oleva peptidoglükaani sünteesi. Selle tulemusel on toimunud muutused bakterite rakuseina peptidoglükaani kihis ja Grampositiivsed bakterid värvuvad kui Gramnegatiivsed.
Vale Grampositiivsed rakud:
- Äigepreparaadis on liiga palju bakterirakke koos, mille tõttu tihedas Gramnegatiivsete rakkude kihis ei kandu dekoloraator kõikide rakkudeni ja ei saa lahustada rakkude välismembraani fosfolipiidide kihti. Kristallviolett jääb Gramnegatiivsete bakterite rakuseina püsima, mistõttu järelvärvimine punast värvi safraniini või karboolfuksiiniga ei anna tulemust.
- Mikroobiliigi eripära.
2.3.7.4 Katalaastest
Katalaastesti põhimõte
Katalaastestiga määratakse bakteril ensüümi katalaas olemasolu. Katalaas lagundab toksilise hapniku metaboliidi vesinikperoksiidi veeks ja hapnikuks, kaitstes sellega bakterit. 18-24 tunni vanune bakterikultuur segatakse 3% vesinikperoksiidiga, välditakse söötme (eriti veriagari) sattumist testikeskkonda. Positiivse testi korral on hapniku teke nähtav mullidena, negatiivse testi korral mullid puuduvad või on nähtavad väga nõrgalt. Ensüüm katalaas on olemas bakteritel, kes hingavad, kasutades hapnikku terminaalse elektronaktseptorina. Sellisteks bakteriteks on ranged aeroobid ja mittefermenteerivad fakultatiivsed anaeroobid. Anaeroobidel ja fermenteerivatel fakultatiivsetel anaeroobidel (Streptococcus spp) katalaas puudub. Testi läbiviimiseks kasuta kolooniat MSA agarilt, kuna veri sisaldab katalaasi ja võib anda valepositiivseid tulemusi.
Tööks vajalikud vahendid
- Vesinikperoksiidi 3% lahus
- Pasteuri pipett
- Steriilne ühekordne külviaas
- Alusklaas
- Uuritav kultuur MSA-lt
- Kollane erimärgistusega prügikott ja kollane erimärgistusega läbimatu konteiner teravatele ja lõikavatele vahenditele (näiteks alusklaasidele)
Katalaastesti töökäik
- Kanna Pasteuri pipetiga alusklaasile tilk 3–5% vesinikperoksiidi lahust;
- Võta MSA agarilt külviaasaga uuritavat kultuuri ning suspendeeri vesinikperoksiidi tilgas;
- Mikroobidega kokku puutunud vahendid aseta kollasesse erimärgistusega prügikotti, teravad ning lõikavad vahendid kollasesse erimärgistusega läbimatusse konteinerisse.
Positiivse reaktsiooni puhul on kultuuri suspendeerimise järgselt näha tilgas mullide teket (Joonis 8). Negatiivse reaktsiooni puhul mullid puuduvad.

2.3.7.5 Oksüdaastest
Oksüdaastesti põhimõte
Oksüdaastestiga tehakse kindlaks kas mikroob produtseerib tsütokroom c oksüdaasi – ensüümi, mis oksüdeerib tetrametüül-p-fenüleendiamiini lillakassinist värvi indoolfenooliks (oksüdaastest on positiivne). Kui bakteril tsütokroom c oksüdaas puudub, siis reagendi värvus jääb muutumatuks ehk värvusetuks (oksüdaastest on negatiivne). Kõik oksüdaaspositiivsed bakterid on võimelised kasvama aeroobses keskkonnas, oksüdaasnegatiivsed bakterid võivad olla aeroobid, fakulatiivsed anaeroobid või anaeroobid. Tavaliselt tehakse oksüdaastesti Gramnegatiivsete Enterobacteriaceae sugukonda kuuluvate pulkbakterite (oksüdaasnegatiivsed) ja Pseudomonas ja Neisseria perekondadesse kuuluvate bakterite (oksüdaaspositiivsed) eristamiseks. Valenegatiivse tulemuse oksüdaastestil võivad anda kultuurid, mis on võetud fermenteeritavaid sahhariide sisaldavalt söötmelt (näiteks laktoosiga MacConkey agar) ja seetõttu on bakterid vähendanud keskkonna pH alla 5,1, mis inhibeerib oksüdaasreaktsiooni. Oksüdaastesti jaoks võetakse bakterirakud kas veriagarilt või mõnelt teiselt söötmelt, mis fermenteerivaid sahhariide ei sisalda ja seega pH bakterite kasvu korral ei vähene. Vajadusel tehakse oksüdaastesti korrektseks sooritamiseks ümberkülv sobivale söötmele. Oksüdaastest võimaldab eristada katalaas-positiivseid, kuid morfoloogiliselt eristamatuid Staphylococcus spp ja Micrococcus spp. Stafülokokid on oksüdaasnegatiivsed ning Micrococcus spp – oksüdaaspositiivsed.
Vajalikud ettevalmistused
Kõik vajalikud vahendid paiguta lauale töö tegemiseks sobivasse järjekorda:
- Oksüdaasreagent tetrametüül-p-fenüleendiamiini lahus või sellega immutatud oksüdaastesti ribad
Vahendid oksüdaastesti vedela reagendi kasutamise korral
- Oksüdaastesti (tetrametüül-p-fenüleendiamiini) lahus
- Alusklaas
- Filterpaber
- Steriilne ühekordne külviaas
- Uuritava kultuuriga Petri tass
- Taimer
- Kollane erimärgistusega prügikott ja kollane erimärgistusega läbimatu konteiner teravatele ja lõikavatele vahenditele (alusklaasidele)
Oksüdaastesti töökäik vedela reagendi korral
- Aseta puhtale alusklaasile sobiva suurusega tükk filterpaberit
- Ava oksüdaasreagendiga (tetrametüül-p-fenüleendiamiini lahusega) ampull ning kanna vedelik filterpaberile
- Võta külviaasaga uuritavat kultuuri ning kanna see oksüdaasreagendiga immutatud filterpaberile
- Aseta kasutatud ühekordne külviaas kollasesse erimärgistusega prügikotti
- Hinda testi tulemust 10-30 sekundi jooksul
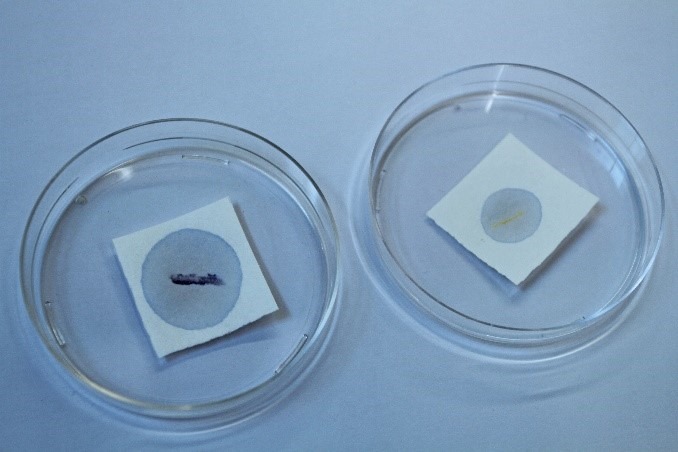
- Tulemuse hindamisel järgi testi tootja juhiseid. Test on positiivne, kui oksüdaasreagendiga kokku puutunud kultuur filterpaberil muutub lillakassiniseks või siniseks (joonis 9 A vasakpoolsel Petri tassil), näiteks Micorococcus luteus korral. Testi tulemus on negatiivne, kui filterpaberil oksüdaasreagendiga immutatud osa värvus ei muutu (joonis 9 A parempoolsel Petri tassil), näiteks Staphylococcus aureus korral.
Vahendid oksüdaasreagendiga immutatud testriba kasutamisel
- Oksüdaastesti ribad
- Petri tass uuritava kultuuriga
- Taimer
- Kollane erimärgistusega prügikott
Oksüdaastesti töökäik testiribade kasutamise korral
- Lase testribasid sisaldaval konteineril soojeneda toatemperatuurile
- Niisuta reagendiga immutatud riba osa ca 10 µl destilleeritud veega
- Aseta reagendiga immutatud riba osa otse bakterikolooniale
- Hinda tulemust 1 minuti jooksul
- NB! Kui kasutad bakterikoloonia kandmiseks reagendiga immutatud riba osale külviaasa, siis ei tohi see olla metallist
- Kasutatud testiriba aseta kollasesse erimärgistusega prügikotti
- Tulemuse hindamisel järgi testi tootja juhiseid. Test on positiivne, kui oksüdaasreagendiga kokku puutunud kultuur testribal muutub lillakassiniseks või siniseks (joonis 9 B vasakpoolsel testiribal). Testi tulemus on negatiivne, kui testriba oksüdaasreagendiga immutatud osa värvus ei muutu (joonis 9 B parempoolsel testiribal)
2.3.7.6 API® testsüsteem
API® testsüsteem on mitteautomaatne bakterite/seente liigi tasemel biotüpiseerimise süsteem. See koosneb inkubatsiooni karbist ja mitmetest mikrokatsutitest, milles on erinevad dehüdreeritud subtraadid bakterite/seente biokeemilise aktiivsuse määramiseks ning reaktiivide kompektist. Sobiva API® testi valimise eelduseks on vähemalt seente ja bakterite eristamine ja bakteri rakuseina tüübi kindlaksmääramine Grami järgi värvimisega ja/või spetsiifiliste testide tegemine. API® testi mikrokatsutites olevate substraatide inokuleerimiseks valmistatakse kindlas kasvufaasis olevast bakteri või seene puhaskultuurist kindla optilise tihedusega (mikroobide arvukusega) suspensioon. Mikroobi suspensiooni optiline tihedus mõõdetakse densitomeetriga. Peale mikrokatsutite inokuleerimist kultuure inkubeeritakse ja hinnatakse tulemused. Tulemustele antakse numbrilised väärtused ja saadakse unikaalne kood, mis sisestatakse vastava API® testi programmi. Programm võrdleb numbriliste väärtuste abil testiga kindlaks tehtud tunnuseid varem klassifitseeritud mikroobide samade tunnustega. Võrdlemise tulemusel leiab programm etalontüve ja uuritava bakteri vahelise sarnasuse koefitsiendi (protsendi). Tunnuseid saab võrrelda ka API® juhendis oleva tabeli alusel manuaalselt.
Vajalikud ettevalmistused API Staph® testi tegemiseks
Inkubaator peab olema eelsoojendatud 37 oC-ni
Kontrolli originaalpakendilt API Staph® testribade säilivuskuupäeva
Soojenda külmkapist võetud API Staph® testribad ja mineraalõli toatemperatuurile
Kõik vajalikud vahendid paiguta lauale töö tegemiseks sobivasse järjekorda
- API Staph® testi tootjapoolne juhend
- Ühekordsed steriilsed külviaasad
- Statiiv katsutitele
- Katsuti steriilse füsioloogilise lahusega
- Optilise tiheduse mõõtja (densitomeeter)
- Vorteks – segaja
- API Staph® testriba
- API Staph® testriba läbipaistvast plastikust inkubatsiooni karp
- Ühekordsed steriilsed Pasteuri pipetid
- Mineraalõli
- Tilgapudel destilleeritud veega
- Kollane erimärgistusega prügikott ja kollane erimärgistusega läbimatu konteiner teravatele ja lõikavatele vahenditele (alusklaasidele)
APIStaph® testi tegemine
- Mõõda densitomeetriga katsutis oleva füsioloogilise lahuse algtihedus ning märgi see üles
- Tee API Staph® testi jaoks bakterisuspensioon 0,5 MacFarlandit:
- Võta steriilse külviaasaga uuritava bakteri kultuuri ning suspendeeri see füsioloogilisse lahusesse
- Sega suspensiooni vorteks – segajal
- Mõõda densitomeetriga suspensiooni optiline tihedus
- Vajadusel lisa suspensioonile veel uuritavat kultuuri või steriilset füsiloogilist lahust, et saavutada nõutud optiline tihedus ja vajadusel korda eelnevaid etappe
- Aseta kasutatud külviaas kollasesse erimärgistusega prügikotti
- Markeeri API Staph® testribade inkubatsioonikarbi väljaulatuv osa vajalike andmetega (proovi identifitseerimise märgis, uuringu tegija nimi, kuupäev jm)
- Kanna tilgapudeliga API Staph® testriba inkubeerimise karbi põhja (süvenditega pool) destilleeritud vett, et vältida inkubeerimise käigus mikrokatsutitesse kantud suspensiooni kuivamist
- Aseta testriba niisutatud inkubatsioonikarbi põhja
- Täida Pasteuri pipetti kasutades API Staph® testribal olevad mikrokatsuteid (joonis 10) eelnevalt valmistatud mikroobisuspensiooniga vastavalt tootja juhistele, mikrokatsutitesse ei tohi täitmise protsessis tekkida õhumulle
- Aseta kasutatud Pasteuri pipett kollasesse erimärgistusega prügikotti
- Lisa tilk õli ADH ja URE katsutisse anaeroobse keskkonna loomiseks
- Sulge inkubatsioonikarp ja inkubeeri 18–24 tundi temperatuuril 36 °C ± 2 °C.
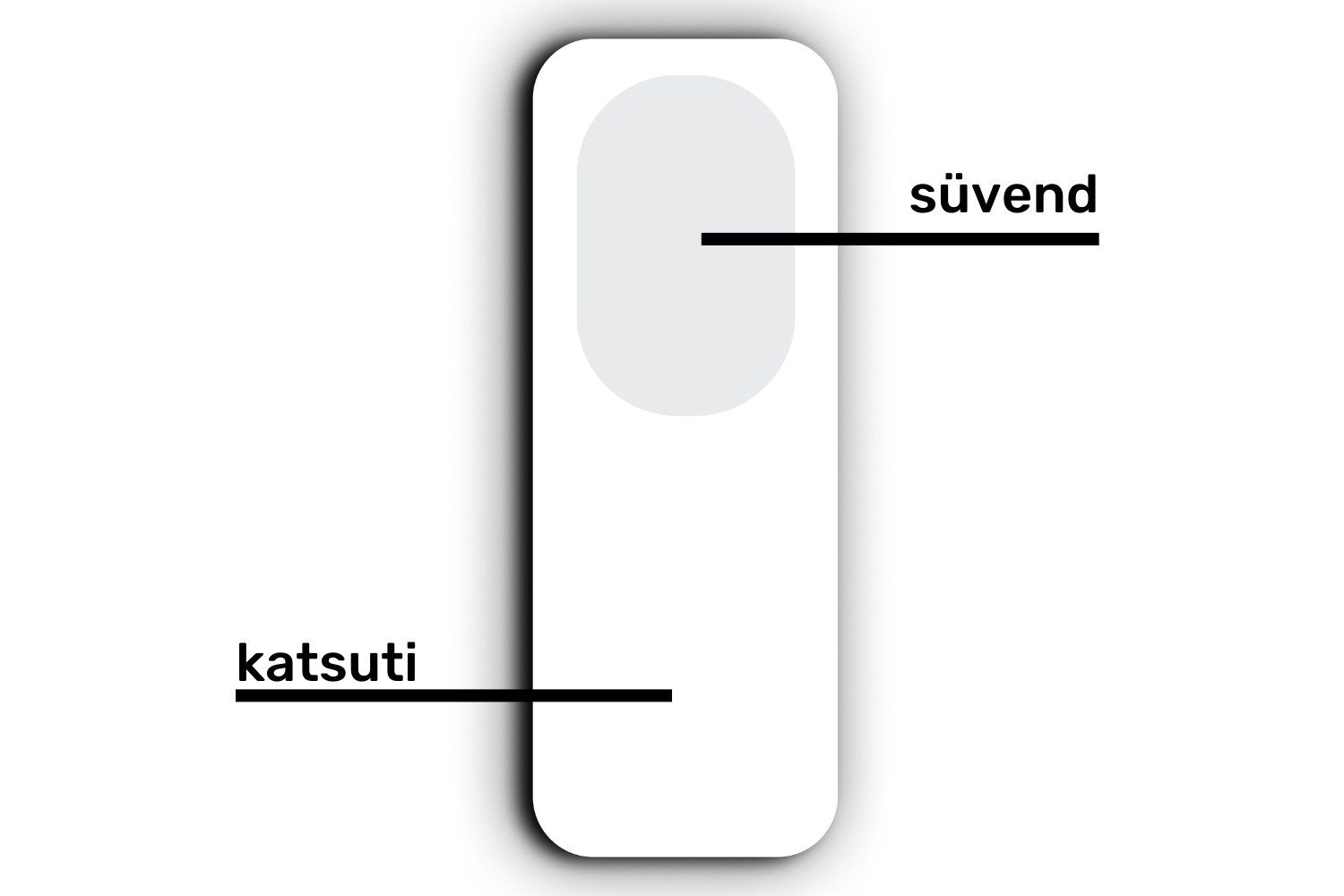
NB! Hoia alles kõik väljakasvudega agarid järgmise uuringupäeva lõpuni.
2.3.8. KOLMAS UURINGUPÄEV
2.3.8.1. API Staph® testi hindamine
Vajalikud ettevalmistused
- Võta termostaadist sinna eelnevalt pandud API Staph® inkubatsioonikarp ja külmkapist toatemperatuurini soojenema reagendid
- Ava arvutis apiweb TM programm ja valige API Staph® testiprogramm
Valikud vahendid
- API Staph® testi reagendid
- API Staph® inkubatsioonikarp
- Tootjapoolne juhend ja hindamisleht
Hindamiskäik
- Pärast inkubatsiooni lisa VP, NIT ja PAL mikrokatsutitesse 1 tilk järgnevaid reagente:
- VP test: VP 1 ja VP 2 reagendid
- NIT test: NIT 1 ja NIT 2 reagendid
- PAL test: ZYM A ja ZYM B reagendid
- Hinda reaktsioonide tulemusi 10 minuti möödumisel lähtudes tootja-poolsest tulemuste hindamise tabelist
- Märgi kõikides mikrokatsutites toimunud reaktsioonide tulemused hindamislehele
- Positiivse reaktsiooni korral märgi tulemuste lehele vastava katsuti kohale „+“ ning negatiivse reaktsiooni korral „–“. Tulemuste lehel on testid jagatud kolmekaupa gruppidesse, vastavalt väärtustega 1, 2 ja 4
- Liida iga grupi positiivsetele tulemustele vastavad arvväärtused ning kirjuta summa grupi all olevasse lahtrisse
- Kandes iga grupi summad arvutis olevasse hindamisprogrammi, kuvatakse sisestatud numbrite kombinatsioonile vastavate mikroobide nimed ning protsentarvud (Joonis 11)
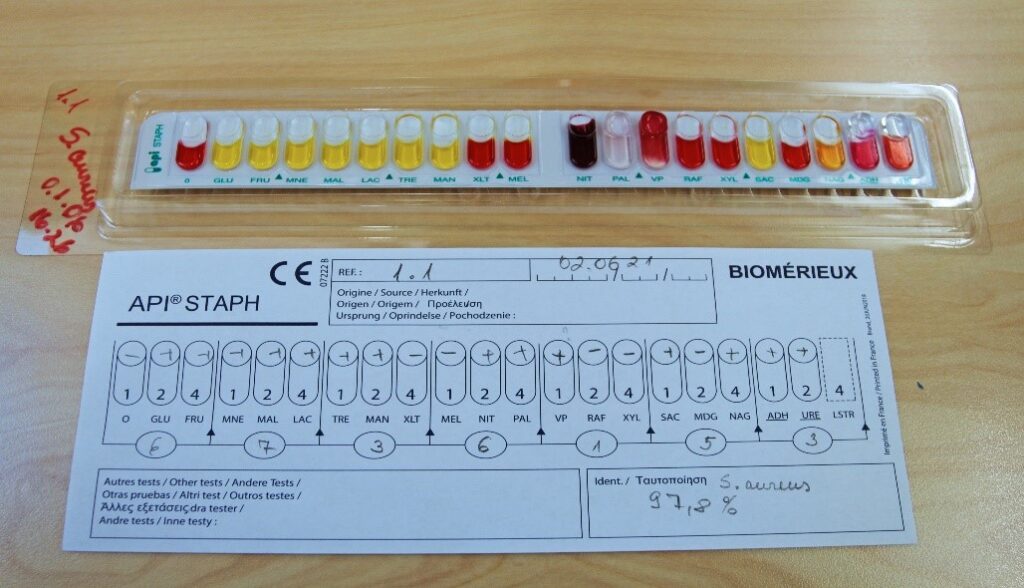
Kui samastamisel on saadud Staphylococcus aureus, siis MRSA (metitsilliinresistentne S. aureus) väljaselgitamine algab 2.3.8.2 punktis toodud juhise järgi.
2.3.8.2 Külv ORSAB agarile
Oxacillin Resistance Screening Agar Base (ORSAB) on selektiivne kromogeenne sööde metitsilliinresistentse Staphylococcus aureus’e (MRSA) skriininguks.
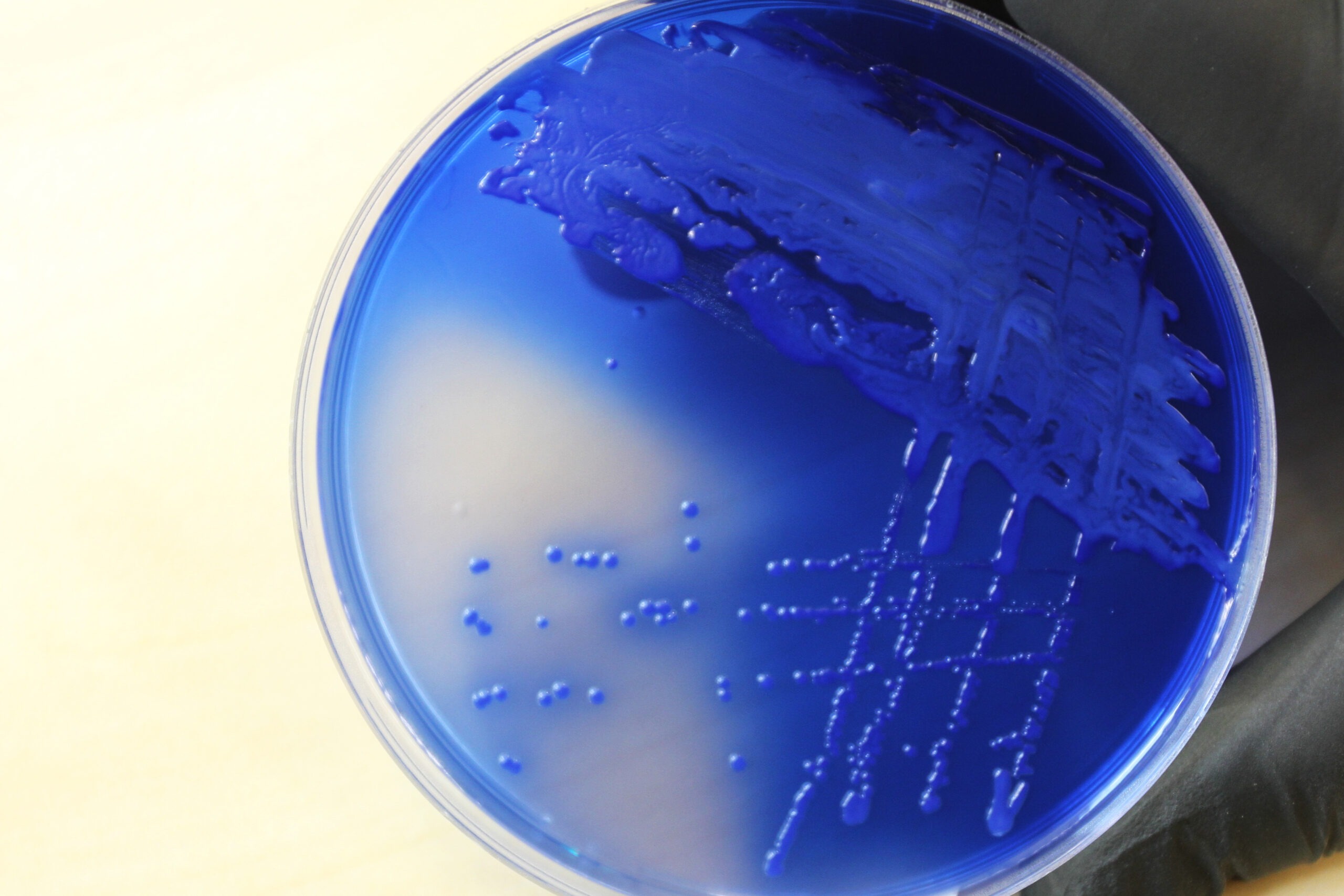
ORSAB agar põhineb MSA agaril, sisaldades veidi vähem soola (55 g/l) kui MSA (75 g/l). Toitainena sisaldab sööde peptoone, MSA koostises olev liitiumkloriid ja kõrge soola kontsentratsioon pärsivad mitte-stafülokokkide kasvu. Lisaks tavapärastele koostisosadele lisatakse ORSAB agarile oksatsilliini 2mg/l, et pärssida metitsiliinile tundlike stafülokokkide kasvu. Teiste kõrget soola kontsentratsiooni taluvate bakterite (Proteus spp) inhibeerimiseks on söötmele lisatud polümüksiin B. Mannitooli fermentatsiooni tulemusel muutuvad MRSA pesad ORSAB agaril siniseks, seda aitab tuvastada indikaator aniliinsinine (Joonis 8). Lisaks värvuse muutusele iseloomustavad MRSA kasvu ORSAB agaril läikivad, limased, opaaksed pesad. MRSA kinnitamiseks tee PBP2 test (punkt 2.3.9.2).
Võta proovimaterjal VA’lt ja tee poolkvantitatiivne külv ORSAB agarile (näidatud joonisel 2).
2.3.9. NELJAS UURINGUPÄEV (MRSA SAMASTAMINE)
2.3.9.1. Kasvu hindamine
Pärast 18–24 tunnist inkubeerimist võta inokuleeritud ORSAB agar termostaadist välja ja hinda MRSA-le iseloomulike pesade esinemist (joonis 12)
2.3.9.2. Penicillin-Binding Protein (PBP2) testi kasutamine
PBP2 lateksaglutinatsiooni testi abil on võimalik vähese aja ja töö kuluga usaldusväärselt määrata metitsilliinresistentseid Staphylococcus spp. Meetodi eelis genotüübilise mecA geeni määramise ees on valepositiivsete tulemuste välistamine, kuna mecA geen on fenotüübis valguna (penicillin binding protein 2a) avaldunud. Test põhineb spetsiifiliste monoklonaalsete antikehade kasutamisel, mis ühinedes metistiliinresistentse Staphylococcus spp valgu PBP2a-ga moodustavad komplekse ning need omakorda kogumikke, mis on silmaga nähtavad.
Vajalikud ettevalmistused
Testi läbiviimiseks kasuta värsket 18–24 tunnilist puhaskultuuri ORSAB agarilt
Tööks vajalikud vahendid
- PBP2 vastaste monoklonaalsete antikehadega sensibiliseeritud latekstest
- Negatiivne kontroll
- Ekstraktsiooni reaktiiv 1
- Ekstraktsiooni reaktiiv 2
- Kahekohaline testialus
- segamispulgad
- 50 μl mikropipett koos otsikutega
- 1– 3 μl külviaasad
- Vorteks-segaja
- Vesivann
- Statiiv
- Mikrokatsuti
- Mikrotsentrifuug
PBP2a testi töökäik
- Tilguta 4 tilka ekstraktsiooni reaktiivi 1 mikrokatsutisse
- Võta 1 μl külviaasaga 3–5 korda kultuuri ja suspendeeri kasutades vorteks-segajat
- Aseta mikrokatsuti kuuma vette statiivi peale ja hoia 3 minutit 95 ºC juures
- Võta mikrokatsuti välja ning jahuta toatemperatuurini
- Lisa mikrokatsutisse 1 tilk ekstraktsiooni reaktiivi 2 ja sega korralikult vorteks-segajaga
- Tsentrifuugi mikrokatsuti 5 minutit 1500 rmp juures
- Võta mikrokatsuti välja ning kasuta supernatanti
- Võta kahekohaline testialus: ühte ringi tilguta 1 tilk test-lateksit ja lisa 50 μl supernatanti, teise ringi tilguta 1 tilk kontrollreaktiivi ja lisa 50 μl supernatanti
- Sega ühtlaselt segamispulkadega, kasutades iga ringi jaoks uut segamispulka
- Kui on tekkinud ühtlane segu igas ringis, kalluta testialust ringjate liigutustega aglutinatsiooni tekkemiseni, mis peab ilmuma kolme minuti jooksul
Tulemuste hindamine
Positiivne tulemus: kui kolme minuti jooksul tekivad testalusel suured ja silmaga hästi nähtavad kogumikud (aglutinatsioon, joonis 13 L), vedelik muutub läbipaistvaks ning kontroll on negatiivne (kogumikud puuduvad) (Joonis 13 ).
Negatiivne tulemus: testalusel kogumikud puuduvad ja suspensioon jääb häguseks, kontroll on negatiivne.
Tulemust ei arvestata: kontrollalusel tekib aglutinatsioon

2.3.10. ÜLESANNE
Koosta juhendi põhjal kõiki võimalusi arvesse võttev skeem (samm-sammuline tegevusjuhis, juhend, eeskiri, reeglistik ehk algoritm) Staphylococcus spp ja MRSA isoleerimise ja samastamise kohta ning märgi sellele kvaliteedi kontrolli kohad.