2.2 JUHEND SALMONELLA SPP ISOLEERIMISEKS JA SAMASTAMISEKS
| Tartu Tervishoiu Kõrgkool Bioanalüütika labori kvaliteedikäsiraamat | ||
| Koostas: | Marina Stepanenkova | Kuupäev 01.03.2019 |
| Kinnitas: | Marika Külm, Triin Aasmäe | Kuupäev 01.03.2019 |
2.2.1. MEETODI ULATUS
Meetod on mõeldud Salmonella spp isoleerimiseks ja samastamiseks Tartu Tervishoiu Kõrgkooli mikrobioloogia õppelaboris.
2.2.2. MEETODI KEHTIVUS
Meetod kehtib kasutamiseks õppetöös: JAH
Meetod kehtib kasutamiseks teadusuuringute teostamisel: JAH
Meetod kehtib kliiniliseks kasutamiseks patsiendi proovide teostamisel: EI
2.2.3. ANALÜÜSI EESMÄRK
Juhend on koostatud Salmonella spp isoleerimiseks ja samastamiseks roojast API® testsüsteemide abil.
2.2.4. TÖÖ OHUTUS
Laboris töötamisel tuleb järgida kõrgkoolis kehtivat „Laboris töötamise ohutuseeskirja“. Töö alustamisel ja lõpetamisel puhastatakse ning desinfitseeritakse tööpinnad. Proovide saabumisel laborisse käideldakse neid kinnastes ja ettevaatusega, kui bioloogilise ohu allikaid. Esmakülvide tegemisel kasutatakse kindaid, mis peale töö sooritamist pannakse bioloogilise ohu kollasesse prügikotti enne, kui külvid asetatakse termostaati. Kõikide mikrobioloogiliste tööde tegemisel järgitakse aseptika reegleid.
Mikrobioloogia labor on tähistatud bioloogilise ohu märgiga (Joonis 1).

2.2.5. PROOVIMATERJALI KOGUMINE JA SÄILITAMINE
- Rooja võtmine proovinõusse:
Salmonella spp tuvastamiseks kasuta roojaproovi, mis aseta spetsiaalsesse lusikaga lisanditeta proovinõusse (Tabel 1). Võta hernetera suurune kogus materjali (võimalusel vali limaseid ja veriseid kohti) ning pane proovinõusse. Markeeri proovinõu patsiendi nime, isikukoodi, kuupäeva ja kellaajaga.
- Rektaalkaape võtmine:
Kasuta spetsiaalset tampooniga ja transportsöötmega katsutit (Tabel 1). Enne proovi võtmist niisuta tampoon. Rektaalkaabe võta tampooniga 3-5 cm sügavuselt pärakust, hõõrudes tampooni ringjate liigutustega vastu limaskesta. Pane võetud materjaliga tampoon katsutisse transportsöötmesse ja markeeri katsuti patsiendi nime, isikukoodi, kuupäeva ja kellaajaga.
- Proovimaterjali säilitamine:
Proov saadetakse laborisse 1–3 tunni jooksul pärast proovi võtmist.
Roojatopsis olevat proovi säilitatakse temperatuuril +2 kuni +8˚C mitte kauem kui 24 tundi.
Transportsöötmes olevat proovi võib säilitada toatemperatuuril +20 kuni +25˚C mitte kauem kui 24 tundi.
| Proovimisnõud | Materjal | Säilitamine |
Roojatops | Roe | Temperatuur: 2 ˚C kuni 8 ˚C Aeg: 24 tundi |
Tabel 1. Proovimaterjali kogumine ja säilitamine. Transportsöötmega katsuti uus pilt, vt videos olevat
2.2.6. ESIMENE UURINGUPÄEV
2.2.6.1. Esmaskülvid Hektoen, XLD söötmele ja seleniit-puljongisse
Hektoen agar on mõeldud Shigella spp ja Salmonella spp isoleerimiseks ja eristamiseks teistest sugukonna Enterobacteriaceae liikidest. Hectoen agar sisaldab suuremas kontsentratsioonis peptoone, et korvata sapisoolade kasvu takistavat toimet bakteritele, eriti oluline on see Shigella spp kasvu tagamiseks. Sapisoolad pärsivad eelkõige Grampositiivsete bakterite kasvu. Süsivesikute allikateks on laktoos, sahharoos ja salitsiin, mis on olulised fermeteerivate ja mittefermenteerivate bakterite eristamiseks.
Söötmes on indikaatoriteks happeline fuksiin ja broomtümool sinine. Kahe indikaatori kasutamine võimaldab kummagi kontsentratsiooni vähendada ja seeläbi minimeerida nende toksilisust, kindlustades sellega söötmel parema bakterite kasvu. Süsivesikute fermentatsiooni tagajärjel muutub keskkond happeliseks, mille tagajärjel muudab broomtümool sinine söötme kollaseks. Salmonella spp ja Shigella spp ei fermenteeri neid suhkruid ja sööde ning pesad on selle tulemusel sinakasrohelised. Peptoonide metabolismi käigus muutub keskkond aluseliseks ning mille tõttu muudab fuksiin söötme punaseks. Söötme koostisesse on lisatud raudammoonium tsitraat. Salmonella spp tüved toodavad ensüümi, mis põhjustab tiosulfaadist sulfiidi molekuli vabanemise. Viimane moodustab vesinikuga gaasi H2S (divesiniksulfiid). H2S reageerib raudammoonium tsitraadiga, tekitades raudsulfiidi musta sademe, mis põhjustab musta keskosaga või üleni mustade pesade tekkimise. Hektoen agaril kasvavad Salmonella spp. tüved musta tsentriga roheliste pesadena (tüved produtseerivad H2S-i) (Joonis 3), mõnedel tüvedel must tsenter puudub (tüved, mis ei produtseeri või produtseerivad H2S vähesel määral: näiteks S. Paratyphi A, S. Typhi). Hektoen agar sisaldab veel sapi soolasid, mis koos värvidega inhibeerivad Grampositiivseid baktereid, andes sellega võimaluse söötmel kasvada Gramnegatiivsetel bakteritel.
XLD agar (Xylose Lysine Deoxycholate Agar) on selektiivne agar, mis on mõeldud Salmonella spp. ja Shigella spp eristamiseks nii kliinilistest proovidest (näiteks roojast) kui toiduainetest ning veest. Selektiivseks muudab söötme naatriumdesoksükolaat, mis inhibeerib enamuse grampositiivsetest bakteritest ja mõjub inhibeerivalt kolilaadetele bakteritele, kuid ei takista Salmonella spp ja Shigella spp kasvu. Ksüloos ja indikaator fenoolpunane aitavad eristada Shigella spp teistest enterobakteritest. Shigella spp ksüloosi ei fermenteeri ja keskkond jääb muutumata, indikaatori värvus jääb punaseks või roosaks. Teised enterobakterid, fermenteerides kiiresti ksüloosi, muudavad keskkonna happeliseks ning söötme värvus muutub kollaseks. Lüsiin on lisatud söötme koostisesse Salmonella spp eristamiseks teistest enterobakteritest, kes fermenteerivad ksüloosi. Kui salmonellad on söötmest ära kasutanud ksüloosi (sööde muutub happeliseks ja kollaseks), siis hakkavad nad kasutama söötmes olevat lüsiini ensüümi lüsiini dekarboksülaas abil ning selle tulemusel muutub pH söötmes aluseliseks, mis visuaalselt on sarnane Shigella spp kasvule (kolooniad ja sööde on punased).
Salmonella spp ja Shigella spp eristamiseks söötmes kasutatakse H2S indikaatorsüsteemi, mille koosseisu kuuluvad naatriumtiosulfaat ja raudammoonium tsitraat, mis on divesiniksulfiidi moodustumise indikaatoriteks. Salmonellad metaboliseerivad tiosulfaati, produtseerides H2S, mis omakorda reageerides raud ammoonium tsitraadiga tekitab raudsulfiidi musta sademe. Mittepatogeensed H2S produtseerijad lüsiini ei karboksüleeri. Sellega on välditud aluselise keskkonna teke ning sellega ka musta sademe teke, kuna see toimub vaid neutraalses või aluseliseses keskkonnas. XLD agaril on Salmonella spp pesad kas mustad H2S-i produktsiooni tõttu või roosakad (Salmonella Paratyphi A, Salmonella Typhi) (Joonis 4).
Seleniitpuljongit kasutatakse rikastussöötmena. Proovimaterjalis võib esineda liiga vähe uuritavaid baktereid, mistõttu agaritel ei pruugi neile bakteritele iseloomulikud kolooniad ilmneda ning samastamise etappi ei saa teha. Sellise olukorra ennetamiseks tehakse rikastussöötmesse bakterite spetsiifiliseks paljundamiseks külv otse proovimaterjalist. Kui nüüd Hektoen ja/või XLD agarite esmaskülvide hindamisel ilmneb, et neil uuritavate bakterite kasv puudub, saab seleniitpuljongis kasvanud kultuurist teha väljakülvi ja ülejärgmisel päeval alustada välja kasvanud kolooniate samastamisega. Seleniitpuljong on rikastussööde Salmonella spp ja Shigella spp isoleerimiseks roojaproovidest, uriinist, veest ja toiduainetest. Sööde sisaldab petoone, mida uuritavad tüved kasutavad süsiniku ja lämmastiku allikana. Naatriumseleniit inhibeerib Gram positiivsete, Gram negatiivsete, sh kolilaadsete ja enamiku sugukonna Enterobacteriacae liikide kasvu. Tuleb tähele panna, et naatriumseleniit on ühtlasi väga toksiline ja korrosiivne aine, mis põhjustab ka teratogeenset efekti. Selle ainega tuleb vältida naha kontakti. Naatriumfosfaat on puhver söötme pH stabiliseerimiseks ja seleniidi toksilisuse vähendamiseks.
- Aseta töökohale vajalikud vahendid:
- 10µl külviaasad
- Proovinõu proovimaterjaliga
- Söötmed
- Marker Petri tassi/ katsuti markeerimiseks
- Bioloogilise ohumärgistusega kollane konteiner
- Lase XLD, Hektoen agaritel ja seleniitpuljongil enne külvi tegemist soojeneda toatemperatuurini
- Veendu, et vajalikud agarid on kasutamiseks kõlblikud, kontrolli agari kvaliteeti ja säilivusaega
- Veendu, et inkubaatori temperatuur oleks 37 °C, vajadusel seadista
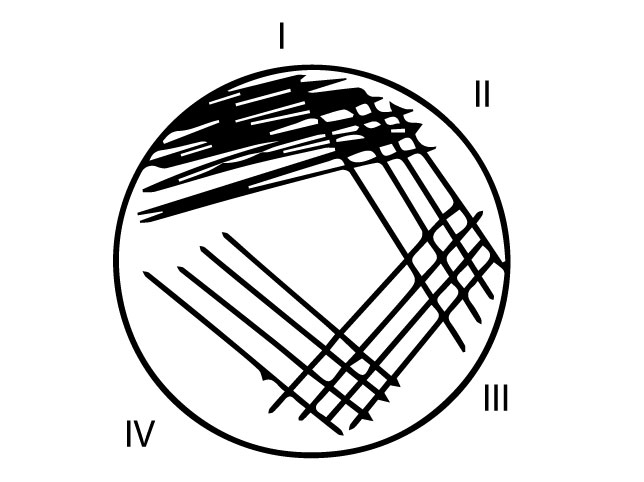
- Külvid tee Hektoen ja XLD söötmetele ning seleniitpuljongisse, kasutades ühte ja sama 10µl külviaasa (Joonis 2)
- Külve inkubeeri 37 ˚C juures 24 tundi
2.2.6.2 Esmaskülvid poolkvantitatiivse külvina agaritele ja seleniitpuljongisse
Märgista Hektoen ja XLD agarid kuupäeva-, proovinumbri- ning oma nimega.
Ava proovinõu:
- Tampooni korral võta kontaminatsiooni vältimiseks ettevaatlikult tampoon proovinõust välja nii, et see ei puutuks proovinõu külge
- Proovitopsis oleva materjali puhul sega proovi enne külvamist ringjate liigutustega
- Proovitopsis olevast roojast võta 10 μl külviaasatäis materjali, võimalusel vali limaseid ja veriseid kohti ja kanna see edasi tagasi liigutustega laiali ühele kolmandikule tassi pinnale (Joonis 2 I sektor)
- Tampoonil olev materjal kanna edasi tagasi liigutustega tampooni roteerides laiali ühele kolmandikule tassi pinnale (Joonis 2 I sektor).
- Kasutades uut steriilset külviaasa ja puudutades I sektorit, tõmba neli paralleelset joont vasakult paremale (Joonis 2 II sektor)
- Keera tassi, vaheta külviaasa poolt ning puudutades II sektorit tõmba neli paralleelset joont vasakult paremale (III sektor)
- Keera tassi, võta uus steriilne külviaas ning puudutades III sektorit tõmba neli paralleelset joont vasakult paremale (IV sektor)
- Seleniitpuljongisse vii 10 μl külviaasatäis materjali, võimalusel vali limaseid ja veriseid kohti ja kergelt külviaasa katsutis edasi-tagasi liigutades kanna materjal puljongisse
- Peale külvamist aseta agarid termostaati 37 °C juurde 18–24 tunniks
- Peale külvamist aseta agarid termostaati 37 °C juurde 18–24 tunniks
2.2.7. TEINE UURINGUPÄEV:
2.2.7.1. Esmaskülvide hindamine
- Võta esmaskülvid inkubaatorist välja
- Hinda kolooniate kasvu agaritel
- Vajadusel tee märkmeid kolooniate iseloomustamiseks ja hindamiseks
- Hektoen ja XLD agaritel välja kasvanud Salmonella spp iseloomulikest pesadest tee biokeemiliste omaduste määramiseks API® 20 E test (ptk 2.2.7.2)
- Väljakülv seletiinpuljongi kultuurist tee juhul, kui Hektoen ja XLD tasside esmaskülvidel Salmonella spp’le iseloomulik kasv puudub

2.2.7.2 API® testsüsteemi põhimõte
API® testsüsteem on mitteautomaatne bakterite/seente liigi tasemel biotüpiseerimise süsteem. See koosneb inkubatsiooni karbist ja mitmetest mikrokatsutitest, milles on erinevad dehüdreeritud subtraadid bakterite/seente biokeemilise aktiivsuse määramiseks ning reaktiivide kompektist. Sobiva API® testi valimise eelduseks on vähemalt seente ja bakterite eristamine ja bakteri rakuseina tüübi kindlaksmääramine Grami järgi värvimisega ja/või spetsiifiliste testide tegemine. API® testi mikrokatsutites olevate substraatide inokuleerimiseks valmistatakse kindlas kasvufaasis olevast bakteri või seene puhaskultuurist kindla optilise tihedusega (mikroobide arvukusega) suspensioon. Mikroobi suspensiooni optiline tihedus mõõdetakse densitomeetriga. Peale mikrokatsutite inokuleerimist kultuure inkubeeritakse ja hinnatakse tulemused. Tulemustele antakse numbrilised väärtused ja saadakse unikaalne kood, mis sisestatakse vastava API® testi programmi. Programm võrdleb numbriliste väärtuste abil testiga kindlaks tehtud tunnuseid varem klassifitseeritud mikroobide samade tunnustega. Võrdlemise tulemusel leiab programm etalontüve ja uuritava bakteri vahelise sarnasuse koefitsiendi (protsendi). Tunnuseid saab võrrelda ka API® juhendis oleva tabeli alusel manuaalselt.
Biokeemiliste omaduste määramine API® 20E testiga
Vajalikud ettevalmistused
Inkubaator peab olema eelsoojendatud 37 oC-ni.
Kontrolli originaalpakendilt API® testribade säilivuskuupäeva.
Soojenda külmkapist võetud API® testribad toatemperatuurile.
Kõik vajalikud vahendid paiguta lauale töö tegemiseks sobivasse järjekorda:
- API® testi tootjapoolne juhend
- Ühekordsed steriilsed külviaasad
- Statiiv katsutitele
- Katsuti steriilse füsioloogilise lahusega
- Optilise tiheduse mõõtja (densitomeeter)
- Vorteks – segaja
- API® testriba
- API® testriba läbipaistvast plastikust inkubatsiooni karp
- Ühekordsed steriilsed Pasteuri pipetid
- Mineraalõli
- Tilgapudel destilleeritud veega
- Söötmed Salmonella spp iseloomulike kolooniatega
- Kollane erimärgistusega prügikott ja kollane erimärgistusega läbimatu konteiner teravatele ja lõikavatele vahenditele (näiteks alusklaasidele)
API® 20 E testi tegemine
- Mõõda densitomeetriga katsutis oleva füsioloogilise lahuse algtihedus ning märgi see üles
- Tee API®20E testi jaoks suspensioon optilise tihedusega 0,5 MacFarlandit:
- Võta steriilse külviaasaga uuritava bakteri kultuuri ning suspendeeri see füsioloogilisse lahusesse
- Sega suspensiooni vorteks – segajal
- Mõõda densitomeetriga suspensiooni optiline tihedus
- Vajadusel lisa suspensioonile veel uuritavat kultuuri või steriilset füsioloogilist lahust, et saavutada nõutud tihedus ja vajadusel korda eelnevaid etappe
- Aseta kasutatud külviaas kollase erimärgistusega prügikotti
- Markeeri API® testribade inkubatsioonikarbi välja ulatuv osa vajalike andmetega (proovi identifitseerimise märgis, uuringu tegija nimi, kuupäev jm)
- Kanna tilgapudeliga API® testriba inkubeerimise karbi põhja (süvenditega pool) destilleeritud vett, et vältida inkubeerimise käigus mikrokatsutitesse kantud suspensiooni kuivamist
- Aseta testriba niisutatud karbi põhja
- Täida Pasteuri pipetti kasutades API® testribal olevad mikrokatsutid eelnevalt valmistatud mikroobisuspensiooniga, mikrokatsutitesse ei tohi täitmise protsessis tekkida õhumulle
- Mikrokatsutite täitmiseks kalluta riba veidi ettepoole ja puuduta pipeti otsaga süvendi külge
 ,
,  ,
,  märgisega täida katsuti osa kui ka süvend,
märgisega täida katsuti osa kui ka süvend, - Teistel mikrokatsutitel täida ainult katsuti osa
- Lisa mineraalõli järgmiste märgistustega mikrokatsutite süvenditesse:
 ,
,  ,
,  ,
, 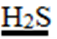 ,
, 
- Sulge inkubatsioonikarp kaanega ning inkubeeri 18–24 tundi temperatuuril 37 °C.
2.2.7.3. Väljakülv seletiinpuljongi kultuurist
NB! Seda etappi tee juhul, kui Hektoen ja XLD tasside esmaskülvide hindamisel (ptk 2.2.7.1) selgub, et Salmonella spp´le iseloomulik kasv puudub!
- Aseta töökohale vajalikud vahendid:
- Ühekordsed 10µl külviaasad
- Seleniitpuljongkultuur
- Vajalikud söötmed
- Kollane bioloogilise ohu märgistusega konteiner
- Marker Petri tassi/ katsuti markeerimiseks
- Veendu, et vajalikud agarid on kasutamiseks kõlblikud
- Soojenda XLD ja Hektoen agarid enne külvi toatemperatuurini
- Markeeri söötmed
- 10µl aasaga tee seleniitpuljongkultuurist poolkvantitatiivselt (Joonis 2) väljakülvid Hektoen ja XLD agaritele
- Inkubeeri külve 37 °C juures 24 tundi
2.2.8. KOLMAS UURINGUPÄEV:
2.2.8.1. API® 20 E hindamine
- Aseta töökohale vajalikud vahendid:
- API® 20 E testsüsteem
- API® 20 E testsüsteemi hindamisleht
- Kollane konteiner ohumärgistusega
- Ava arvutis APIweb programm ja vali API® 20 E
- Võta vajalikud reagendid soojenema: VP1, VP2, IND ja JAMES
- Lisa vajalikud regendid:
- VP mikrokatsutisse lisa üks tilk VP1 ja üks tilk VP2 reagenti
- TDA mikrokatsutisse lisa üks tilk TDA reagenti
- IND mikrokatsutisse lisa üks tilk JAMES reagenti
- Lase testsüsteemil seista 10 minutit toatemperatuuril
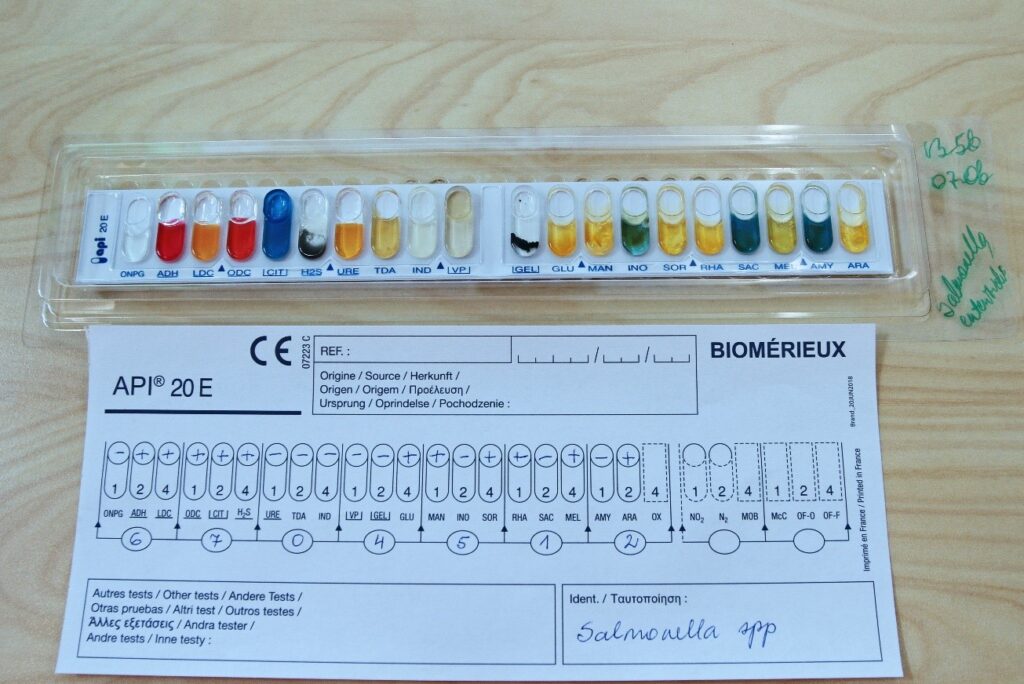
- Hindamislehele märgi „+“ positiivse reaktsiooni ning „-“ negatiivse reaktsiooni korral, kasuta tootjapoolse juhendi hindamistabelit (lisa 1)
- Liida iga grupi positiivsetele tulemustele vastavad arvväärtused ning kirjuta summa grupi all olevasse ringikujulisse lahtrisse
- Summadest saadud numbritest moodustub uuritavale bakterile iseloomulik kood, mis sisesta hindamisprogrammi (näidis on joonisel 6).
2.2.8.2 XLD ja Hektoen agaritel välja kasvanud Salmonella spp iseloomulikest bakterikolooniatest biokeemiliste omaduste määramine
- Hektoen ja XLD agaritel välja kasvanud iseloomulikest pesadest tee API® 20 E test (ptk 2.2.7.2)
2.2.9. NELJAS UURINGUPÄEV
Hinnake API® 20 E (ptk 2.2.8.1)
2.2.10. ÜLESANNE
Koosta juhendi põhjal kõiki võimalusi arvesse võttev skeem (samm-sammuline tegevusjuhis, juhend, eeskiri, reeglistik ehk algoritm) Salmonella spp isoleerimise ja samastamise kohta.