| Tartu Tervishoiu Kõrgkool Bioanalüütika labori kvaliteedikäsiraamat | ||
| Koostas: | Hanna Sepp | Kuupäev 01.12.2015 |
| Kinnitas: | Marika Külm | Kuupäev 01.12.2015 |
2.1.1. MEETODI ULATUS
Meetod on mõeldud uropatogeenide määramiseks Tartu Tervishoiu Kõrgkooli mikrobioloogia õppelaboris. Juhendi järgi toimub põhiliste uropatogeenide isoleerimine ja samastamine.
2.1.2. MEETODI KEHTIVUS
Meetod kehtib kasutamiseks õppetöös: JAH
Meetod kehtib kasutamiseks teadusuuringute teostamisel: JAH
Meetod kehtib kliiniliseks kasutamiseks patsiendi proovide teostamisel: EI
2.1.3. ANALÜÜSI EESMÄRK
Juhend on koostatud uriini mikrobioloogilise uuringu läbiviimiseks põhiliste uropatogeenide näitel, kasutades nende biokeemilise aktiivsuse määramiseks ja lõplikuks samastamiseks API® testsüsteeme.
2.1.4. UURINGUGA SEOTUD OHUTUS

Laboris töötamisel tuleb järgida kõrgkoolis kehtivat „Laboris töötamise ohutuseeskirja“. Töö alustamisel ja lõpetamisel puhastatakse ning desinfitseeritakse tööpinnad. Proovide saabumisel laborisse käideldakse neid kinnastes ja ettevaatusega, kui bioloogilise ohu allikaid. Esmakülvide tegemisel kasutatakse kindaid, mis peale töö sooritamist pannakse bioloogilise ohu märgisega kollasesse prügikotti enne, kui külvid asetatakse termostaati. Kõikide mikrobioloogiliste tööde tegemisel järgitakse aseptika reegleid.
2.1.5. Proovimaterjali kogumine ja säilitamine
Uropatogeenide tuvastamiseks kasutatakse steriilsesse ja hermeetiliselt suletavasse proovinõusse kogutud hommikust (ärkamisjärgset) keskjoa uriini, sh eelmisest urineerimisest ei tohi olla möödunud vähem kui 4-6 tundi. Uriiniproovi võtmisele peab eelnema väliste urogenitaalorganite pesu leige voolava veega ja kuivamine paberkäterätiga. Proovimaterjali võtmisest saate lugeda https://synlab.ee/uriini-kogumine/
Proovimaterjal tuleb laborisse transportida võimalikult koheselt pärast selle kogumist, kuid mitte hiljem kui 30 minuti jooksul toatemperatuuril või 2 h jooksul +4 °C juures hoituna. Uriiniproovi säilivuse pikendamiseks kantakse uriiniproov vaakumkatsutisse 15 minuti jooksul peale selle võtmist, vaakumkatsutis uriin on mikrobioloogiliseks uuringuks sobiv hoituna temperatuuril +2 kuni +8 °C sama päeva jooksul.
Proovivõtunõud uriini kogumiseks
| Proovivõtuvahend | Proovivõtuvahendi nimetus |
 | Steriilne proovikogumisnõu |
 | Uriini kogumisnõu vaakumkatsutile |
 | Uriini katsuti mikrobioloogilise uuringu jaoks |
 | Uriini katsuti |
Tabel 1. Steriilsed uriiniproovi võtmise ja transportimise vahendid
2.1.6. Esimene uuringupäev
2.1.6.1. Esmaskülv CLED ja Sabouraud agaritele
CLED agar
CLED (cysteine-, lactose-, and electrolyte-deficient) agar on välja töötatud spetsiaalselt uropatogeenide diagnoosimiseks. CLED söötmel kasvavad laktoosi fermenteerivad mikroobid kollaste pesadena ning nad muudavad ka söötme pinna kollaseks. Laktoosi mittefermenteerivatele mikroobidele on iseloomulikud sinakasrohelised pesad ja söötme pind. Söötmel on selgelt eristatavad põhilised uriiniproovi kontaminandid nagu laktobatsillid, difteroidid ja mikrokokid. Proteus spp iseloomuliku roomava kasvu vältimiseks on söötme koostises vähendatud elektrolüütide sisaldust.
Sabouraud Dextrose Agar (SDA)
SDA on mitteselektiivne sööde patogeensete ja mittepatogeensete seente isoleerimiseks nii kliinilistest (näiteks röga, rooja, uriin jms) kui mittekliinilistest materjalidest. Seente kasvu toetavad söötme koostises olevad peptoonid ja glükoos ning madal pH väärtus. Söötmele lisatud laia toimespektriga antibiootikum klooramfenikool inhibeerib bakterite kasvu.
Vajalikud ettevalmistused
Soojenda agarid enne inokuleerimist toatemperatuurini.
Hinda agarite kvaliteeti – agarid peavad olema kasvuta, siledapinnalised, õhumullideta ja kondensveeta, valmistamise kuupäevast ei tohiks olla möödas rohkem kui 5 päeva.
Termostaat peab olema eelsoojendatud 37 oC
Kõik vajalikud vahendid paiguta lauale töö tegemiseks sobivas järjekorras
- Steriilsed ühekordsed 1 μl külviaasad
- Korrektselt markeeritud (sh keskjoauriini lühendiga cvU) proovimaterjali sisaldav uriini kogumisnõu, vaakumkatsutid, vajadusel kõrs vaakumkatsuti täitmiseks
- Kvaliteedi nõuetele vastav CLED ja SDA agarid
- Marker Petri tasside markeerimiseks
- Kollane erimärgistusega prügikott ja kollane erimärgistusega torkekindel konteiner teravatele ja lõikavatele vahenditele (näiteks alusklaasidele)
CLED ja Sabouraud agarite inokuleerimine
- Kõikide proovimaterjalide ja mikroobikultuuridega seotud tegevuste korral järgi aseptika reegleid
- Markeeri agaritega Petri tassid proovivõtunõul olevate andmetega, lisa külvamise kuupäev, kellaaeg ja esmaskülvi tegija nimi
- Sega suletud proovivõtunõud ettevaatlikult ringjate liigutusega, võta proovimatejal vaakumkatsutisse
- Võta steriilne 1 μl külviaas
- Materjali võtmiseks kasta 1 μl külviaas uriini sisse (Joonis 2). Oluline on jälgida, et aas asetatakse uriini sisse ja võetakse uriinist välja otse, mitte nurga all. Vastasel korral satub aasale vale kogus materjali
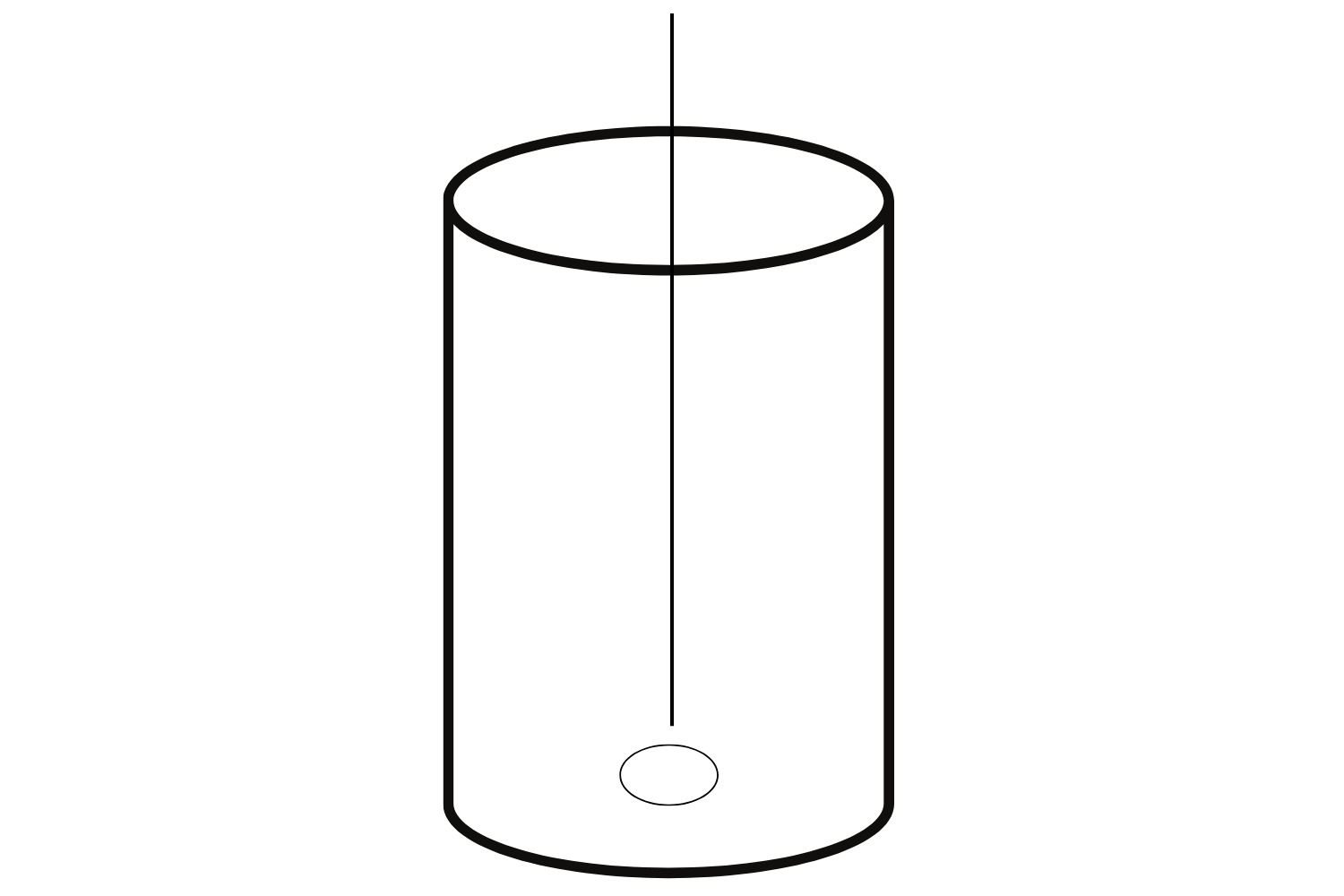
- Ava agariga Petri tass
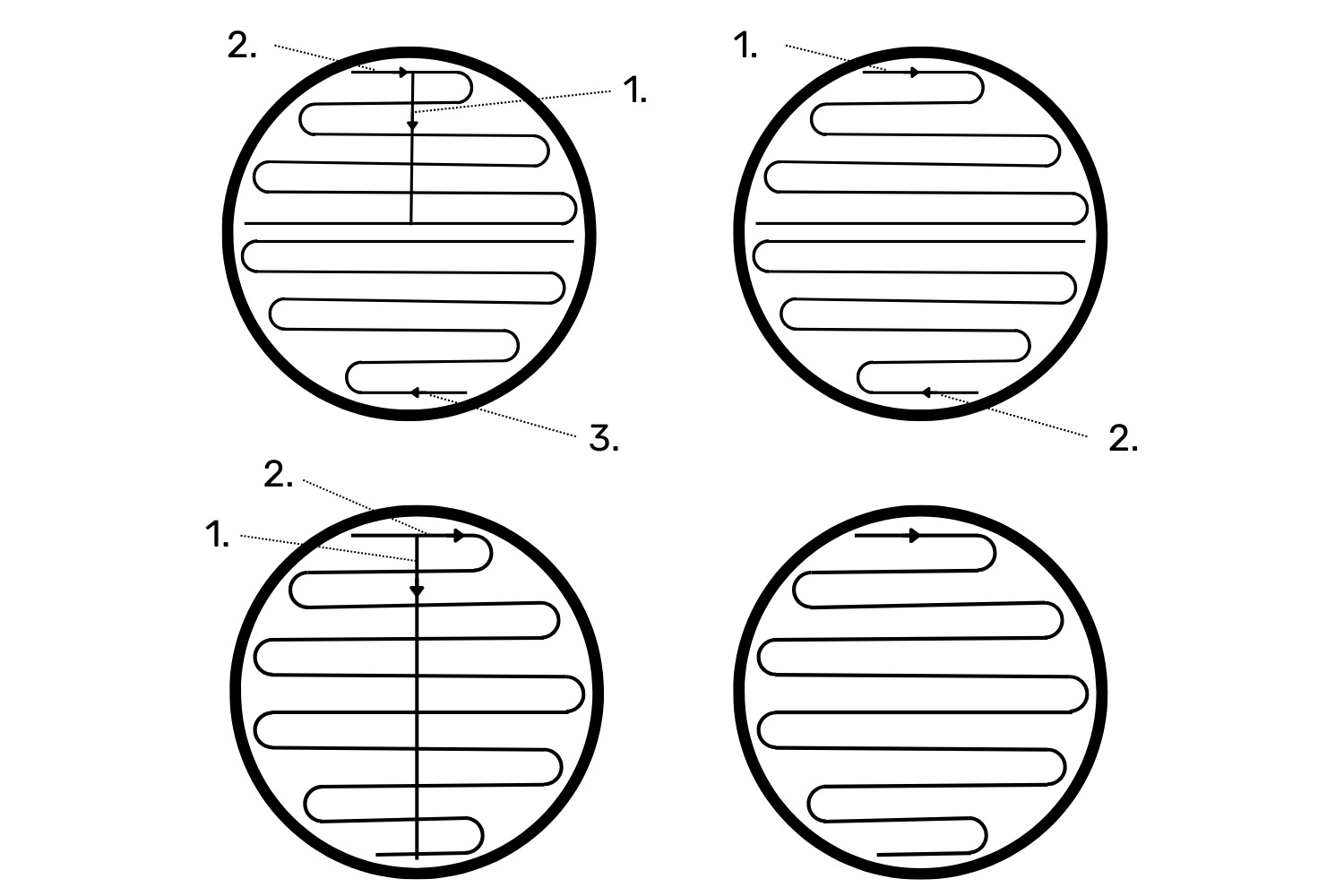
- Kanna aasal olev materjal poolkvantitatiivse külvina agarile, kasutades ühte Joonisel 3 olevatest külviviisidest
- Ühekordne külviaas uuringumaterjaliga ja esmaskülvil kasutatud ühekordsed kindad aseta kollasesse erimärgistusega prügikotti
- Külvi inkubeerimiseks aseta inokuleeritud Petri tassid termostaati 37 °C juurde 24 tunniks. Jälgi, et Petri tassid oleksid põhjaga ülespoole
- Nõud uriiniga aseta jäätmete kogumise alusele, kust need viiakse ohutustamiseks autoklaavimise teel
2.1.7. Teine uuringupäev
2.1.7.1. Kasvude hindamine CLED ja SDA agaritel
- Pärast 18-24 tundi inkubeerimist võta termostaadist Petri tassid välja
- Esmalt hinda segakultuuri võimalikkust, selleks võrdle tassil olevate pesade välimust – värvust, suurust, limasust jm tunnuseid. Kuna kuseteedeinfektsioonid (UTI, Urinary Trackt Infection) on tavaliselt tekitatud korraga ühe, äärmisel juhul kahe mikroobiliigi poolt, siis 1-2 pesa tüübi esinemise korral võib välistada proovimaterjali kontaminatsiooni. Kui agaril on välja kasvanud >= 3 erinevat tüüpi pesasid, siis loetakse proovimaterjal kontamineerunuks ja soovitatakse saata uus proovimaterjal
- Loenda tassidel olevate pesade hulk
- Mikroobide arvukuse hindamisel võetakse arvesse patsiendi vanus, sugu, bakterite kuuluvus primaarsete, sekundaarsete, kahtlaste patogeenide või mittepatogeenide hulka ning proovi võtmise viisi (keskjoauriin, põiepunktaat, püsikateetrist jt). Arvestades järgnevat tabelit (Tabel 2), hinda proovimaterjalis olevate bakterite arvukust.
| Pesade arv | Mikroobide hulk uriinis PMÜ*/ml |
| 1 | 103 |
| 1–9 | <104 |
| 10 | 104 |
| 10–99 | 104–5 |
| ≥100 | ≥105 |
Tabel 2. Uropatogeenide kvantitatiivne hindamine (Laaring 2014).
*PMÜ – pesa moodustavad kolooniad
Bakterid:
- ≥105 PMÜ/ml on üldine infektsiooni kriteerium,
- ≥103 PMÜ/ml on infektsiooni kriteerium, kui tekitajateks on: E.coli, S. saprophyticus, Proteus sp., Pseudomonas sp. (Laaring 2014).
Pärmseened:
- 103–4 PMÜ/ml on infektsioon kriteerium UTI sümptomitega patsiendil,
- 104–5 PMÜ/ml on võimaliku infektsiooni kriteerium,
- ≥105 PMÜ/ml on selge infektsiooni kriteerium (Pirožkova ja Ivanova i.a).
Edasisi uuringuid tehakse vaid selgelt eraldi asetsevatest pesadest. Kui need puuduvad, tuleb samastamise jätkamiseks teha CLED agarile või pärmide korral SDA agarile puhaskultuuri isoleerimine. Eraldi asetsevate pesade olemasolul saab uuringut jätkata kohe esmaskülvist.
2.1.7.2. Äigepreparaadi valmistamine
Vajalikud ettevalmistused
Kõik vajalikud vahendid paiguta lauale töö tegemiseks sobivas järjekorras
- CLED ja SDA agarid uuritava kultuuriga
- Alusklaas
- Steriilsed ühekordsed külviaasad
- Statiiv
- Tilgapudel destilleeritud veega
- Gaasipõleti või piirituslamp
- Pintsetid
- Marker
- Kollane erimärgistusega prügikott ja kollane erimärgistusega torkekindel konteiner teravatele ja lõikavatele vahenditele (näiteks alusklaasidele)
Äigepreparaadi tegemine
- Valmista äigepreparaat Grami värvingu tegemiseks kuni 24 tunni vanusest (so logaritmilises kasvufaasis olevast) bakterikultuurist
- Märgista tassi põhjal markeriga pesa, mida soovid edasistes uuringutes kasutada. Pesa peaks olema võimalikult suur, et materjali jätkuks kõigi järgnevate uuringute jaoks
- Tilguta alusklaasile tilgapudelist väike tilk destilleeritud vett
- Võta ühekordse külviaasaga uuritavast pesast väike kogus materjali ning suspendeeri see ca 1 cm diameetriga ringjate liigutustega destilleeritud vee tilgas. Preparaadi kvaliteet tuleb parem, kui võtad külviaasale võimalikult vähe materjali
- Aseta kultuuriga külviaas kollasesse erimärgistusega prügikotti
- Lase mikroobi suspensioonil õhu käes kuivada. Selle kiirendamiseks võib asetada alusklaasi termostaati 37 oC juurde või gaasipõleti leegi kõrvale, hoidudes kuumutamisest
- Fikseeri preparaat leegis. Selleks võta alusklaas pintsettide vahele ning juhi see 2–3 korda üle gaasileegi, vältides preparaadi mõjutamist liigse kuumusega
- Alternatiivselt võib preparaadi fikseerida metanoolis 30 sekundi jooksul
2.1.7.3. Grami värving
Grami värvingu põhimõte
Bakterirakkude erinev värvumine tuleneb Grampositiivsete ja Gramnegatiivsete bakterite rakuseina erinevast ehitusest. Kristallvioleti vesilahus difundeerub rakku ja seondub bakterirakkude negatiivselt laetud osadega. Joodilahuse lisamisel tekivad bakterirakus suured kristallvioleti ja joodi kompleksid. Grampositiivsete bakterite rakuseinas olev paks peptidoglükaani kiht koos lipiididega takistab järgnevat dekoloreerimist. Gramnegatiivsete bakterite rakuseina peptodoglükaani kiht on õhuke, dekoloreeriva ainega töötlemisel muutub see kristallvioleti-joodi kompleksidele läbitavaks ja värv uhutakse rakust välja. Järgnevalt värvitakse baktereid järelvärvimisel (või vastandvärvimisel) safraniini või karboolfuksiiniga punaseks. Gramnegatiivsed bakterid, millest kristallviolett oli välja uhutud, värvuvad järelvärvimisel safraniini või karboolfuksiiniga punaseks. Grampositiivsete bakterite värvi safraniiniga või karboolfuksiiniga järelvärvimine ei mõjuta, nad värvuvad kristallvioletiga tumesiniseks või tumevioletseks. Pärmseened värvuvad nagu Grampositiivsed bakterid tumesiniseks või tumevioletseks ning on mikroskopeerimisel nähtavad suuremate rakkudena kui bakterid. Värvumine toimub õigesti, kui kasutatakse logaritmilises kasvufaasisi olevaid rakke, mida üldjuhul saab 18-24 tunni vanusest bakterikultuurist.
Vajalikud ettevalmistused
Kõik vajalikud vahendid paiguta lauale töö tegemiseks sobivas järjekorras
- Uuritava kultuuriga äigepreparaat
- Steriilne ühekordne külviaas
- Grami värvinguks vajalikud reagendid – kristallvioleti lahus, Lygoli lahus, dekoloraator, karboolfuksiini või safraniini lahus
- Loputamiseks kolb kraaniveega
- Neerukauss
- Alus preparaadi hoidmiseks
- Preparaadi statiiv
- Pintsetid
- Filterpaber
- Taimer
- Kollane erimärgistusega prügikott ja kollane erimärgistusega torkekindel konteiner teravatele ja lõikavatele vahenditele (näiteks alusklaasidele)
Grami järgi värvimine
Kontrolli Grami värvide säilivusaega. Grami värvingu tegemisel tuleb järgida värvide tootja juhiseid ja vajadusel vastavaid toimimisaegu kohandada
- Aseta äigepreparaat neerukausi kohal olevale preparaadi alusele
- Kata äigepreparaat kristallvioleti lahusega, hoia 1 minut
- Loputa äigepreparaati rohke veega, väldi vee valamist otse preparaadile
- Kanna äigepreparaadile Lygoli lahust, hoia 1 minut
- Loputa rohke veega
- Kanna äigepreparaadile dekoloreeriv lahus, hoia 20 sekundit
- Loputa rohke veega
- Kanna äigepreparaadile safraniini (või karboolfuksiini) lahus, hoia 1 minut
- Loputa rohke veega
- Aseta preparaat preparaadi statiivile ja lase kuivada õhu käes
Mikroskopeerimine
- Kanna kuivanud preparaadile 1–2 tilka immersioonõli
- Mikroskopeerimiseks kasuta 100-kordse suurendusega õliimmersioonobjektiivi
- Hinda preparaadi kvaliteeti ja mikroobide suurust, värvust, kuju ja asetust ning analüüsi vajadusel võimalike vigade esinemist värvingus
- Enam esinevatele uropatogeenidele omased morfoloogilised tunnused Gram’i preparaadis leiad peatükist 9
Grampositiivsete kokkide puhul jätka uuringut katalaastestiga (ptk 2.1.7.4), Gramnegatiivsete pulkbakterite puhul oksüdaastestiga (ptk 2.1.7.5), seente puhul API® Candida testiga (ptk 2.1.7.6).
Võimalikud vead Grami järgi värvimisel
Sinise tooni varieeruvuse põhjused Grami järgi värvimismeetodi kasutamisel:
- Tehnilised vead nagu liiga paks preparaat (baktereid on alusklaasil liiga palju), liigne kuumutamine fikseerimisel, liigne dekoloreerimine, liigne dekoloreerimise järgne loputamine
- Dekoloreerimise kestus peab olema täpne. Kui dekoloraatoriga töödelda liiga kaua, siis võib kristallvioleti välja uhuda ka Grampositiivsetest rakkudest ja need on peale safraniiniga (karboolfuksiiniga) värvimist punased. Kui aga dekoloreerimine toimub liiga lühikest aega, siis võivad ka Gramnegatiivsed bakterid hoida kristallvioletti kinni ja rakud on nähtavad violetsetena ehk tuvastatakse kui vale Grampositiivsed
- Mõnikord on vaja koloriseerimise täpne aeg ise kindlaks teha, kuna tootja annab liiga suure vahemiku. Seda saab teha kontrollkultuure Grami järgi värvides
Vale Gramnegatiivsed rakud:
- Grami järgi värvimisel kasutatakse noori (lag faasi) Grampositiivsete bakterite kultuure
- Grami järgi värvimisel kasutatakse vanu (> 24 h) Grampositiivsed bakterid. Vanade kultuuride rakkudel väheneb kristallvioleti sidumise võime, mistõttu vanad Grampositiivsed rakud võivad reageerida värvidele kui Gramnegatiivsed rakud või anda erinevaid (mitteusaldusväärseid) tulemusi. Gramnegatiivsed rakud värvuvad vanusest sõltumata Gramnegatiivsetena
- Proovimaterjali võtmisele on eelnenud patsiendi ravimine antibiootikumidega, mis pärsivad bakterite rakuseinas oleva peptidoglükaani sünteesi. Selle tulemusel on toimunud muutused bakterite rakuseina peptidoglükaani kihis ja Grampositiivsed bakterid värvuvad kui Gramnegatiivsed.
Vale Grampositiivsed rakud.
- Äigepreparaadis on liiga palju bakterirakke koos, mille tõttu tihedas Gramnegatiivsete rakkude kihis ei kandu dekoloraator kõikide rakkudeni ja ei saa lahustada rakkude välismembraani fosfolipiidide kihti. Kristallviolett jääb Gramnegatiivsete bakterite rakuseina püsima, mistõttu järelvärvimine punast värvi safraniini või karboolfuksiiniga ei anna tulemust
- Mikroobiliigi eripära
2.1.7.4. Katalaastest
Katalaastesti põhimõte
Katalaastestiga määratakse bakteril ensüümi katalaas olemasolu. Katalaas lagundab toksilise hapniku metaboliidi vesinikperoksiidi (H2O2) veeks (H2O) ja hapnikuks (O2), kaitstes sellega bakterit. 18-24 tunni vanune bakterikultuur segatakse 3% vesinikperoksiidiga, välditakse söötme (eriti veriagari) sattumist testikeskkonda. Positiivse testi korral on hapniku teke nähtav mullidena, negatiivse testi korral mullid puuduvad või on nähtavad väga nõrgalt. Ensüüm katalaas on olemas bakteritel, kes hingavad, kasutades terminaalse elektronaktseptorina hapnikku. Sellisteks bakteriteks on ranged aeroobid ja mittefermenteerivad fakultatiivsed anaeroobid ja mikroaerofiilid. Anaeroobidel ja fermenteerivatel fakultatiivsetel anaeroobidel (Streptococcus spp) ensüüm katalaas puudub.
Uropatogeenide diagnostikas on edasiste uuringute tarbeks oluline eristada üksteisest Grampositiivsete kokkide perekondi: Staphylococcus spp (katalaaspositiivne) ja Streptococcus spp (katalaasnegatiivne). Positiivse katalaastesti korral jätkub uuring API® Staph testiga (ptk 2.1.7.6). Negatiivse katalaastesti korral võib olla tegemist Enterococcus faecalis’ga, mille kinnitamiseks külvata kultuur edasi sapi-eskuliini agarile (ptk 2.1.7.7).
Vajalikud ettevalmistused
Kõik vajalikud vahendid paiguta lauale töö tegemiseks sobivas järjekorras
- Vesinikperoksiidi 3% lahus
- Pasteuri pipett
- Steriilne ühekordne külviaas
- Alusklaas
- Uuritav kultuur
- Kollane erimärgistusega prügikott ja kollane erimärgistusega läbimatu konteiner teravatele ja lõikavatele vahenditele (näiteks alusklaasidele)
Katalaastest
- Kanna alusklaasile Pasteuri pipetiga tilk vesinikperoksiidi lahust
- Võta ühekordse mitte metallist külviaasaga uuritavat kultuuri, vältides söötme kaasa haaramist ning suspendeeri seda alusklaasil olevas vesinikperoksiidi tilgas
- Hinda tulemust: testi tulemus on positiivne, kui kultuuri suspendeerimise järgselt on näha vesinikperoksiidi tilgas mullide teke; testi tulemus on negatiivne, kui mullid suspensioonis puuduvad. Katalaastesti tulemust iseloomustab joonis 4.

- Pane kasutatud ühekordne külviaas kollasesse erimärgistusega prügikotti ja alusklaasid kollasesse erimärgistusega läbimatusse konteinerisse
2.1.7.5. Oksüdaastest
Oksüdaastesti põhimõte
Oksüdaastestiga tehakse kindlaks, kas mikroob produtseerib tsütokroom c oksüdaasi, ensüümi, mis oksüdeerib tetrametüül-p-fenüleendiamiini lillakassinist värvi indoolfenooliks (oksüdaastest on positiivne). Kui bakteril tsütokroom c oksüdaas puudub, siis reagendi värvus jääb muutumatuks ehk värvusetuks (oksüdaastest on negatiivne). Kõik oksüdaaspositiivsed bakterid on võimelised kasvama aeroobses keskkonnas, oksüdaasnegatiivsed bakterid võivad olla aeroobid, fakulatiivsed anaeroobid või anaeroobid. Tavaliselt tehakse oksüdaastesti Gramnegatiivsete Enterobacteriaceae sugukonda kuuluvate pulkbakterite (oksüdaasnegatiivsed) ja Pseudomonas ja Neisseria perekondadesse kuuluvate bakterite (oksüdaaspositiivsed) eristamiseks. Valenegatiivse tulemuse oksüdaastestil võivad anda kultuurid, mis on võetud fermenteeritavaid sahhariide sisaldavalt söötmelt (näiteks laktoosiga MacConkey agar) ja seetõttu on bakterid vähendanud keskkonna pH alla 5,1, mis inhibeerib oksüdaasreaktsiooni. Oksüdaastesti jaoks võetakse bakterirakud kas veriagarilt või mõnelt teiselt söötmelt, mis fermenteerivaid sahhariide ei sisalda ja seega pH söötmes bakterite kasvu korral ei vähene. Vajadusel tehakse oksüdaastesti korrektseks sooritamiseks ümberkülv sobivale söötmele.
Enterobacteriaceae sugukonna esindajatele on iseloomulik negatiivne oksüdaasi reaktsioon ning edasiseks samastamiseks tuleks kasutada API® 20 E testi (ptk 2.1.7.6).
Vajalikud ettevalmistused
Kõik vajalikud vahendid paiguta lauale töö tegemiseks sobivas järjekorras
- Oksüdaasreagent tetrametüül-p-fenüleendiamiini lahus või sellega immutatud oksüdaastesti ribad
Vahendid oksüdaastesti vedela reagendi kasutamise korral
- Oksüdaastesti (tetrametüül-p-fenüleendiamiini) lahus
- Alusklaas
- Filterpaber
- Steriilne ühekordne külviaas
- Uuritava kultuuriga Petri tass
- Taimer
- Kollane erimärgistusega prügikott ja kollane erimärgistusega läbimatu konteiner teravatele ja lõikavatele vahenditele (alusklaasidele)
Oksüdaastest vedela reagendi korral
- Aseta puhtale alusklaasile sobiva suurusega tükk filterpaberit
- Ava oksüdaasreagendiga (tetrametüül-p-fenüleendiamiini lahusega) ampull ning kanna vedelik filterpaberile
- Võta külviaasaga uuritavat kultuuri ning kanna see oksüdaasreagendiga immutatud filterpaberile
- Aseta kasutatud ühekordne külviaas kollasesse erimärgistusega prügikotti
- Hinda testi tulemust 10-30 sekundi jooksul
- Tulemuse hindamisel järgi testi tootja juhiseid. Test on positiivne, kui oksüdaasreagendiga kokku puutunud kultuur filterpaberil muutub lillakassiniseks või siniseks (joonis 5 vasakpoolsel Petri tassil). Testi tulemus on negatiivne, kui filterpaberil oksüdaasreagendiga immutatud osa värvus ei muutu (joonis 5 parempoolsel Petri tassil).

Vahendid oksüdaasreagendiga immutatud testriba kasutamisel
- Oksüdaastesti ribad
- Petri tass uuritava kultuuriga
- Taimer
- Kollane erimärgistusega prügikott
Oksüdaastest testiribade kasutamise korral
- Lase testribasid sisaldaval konteineril soojeneda toatemperatuurile
- Niisuta reagendiga immutatud riba osa ca 10 µl destilleeritud veega
- Aseta reagendiga immutatud riba osa otse bakterikolooniale
- Hinda tulemust 1 minuti jooksu
- NB! Kui kasutad bakterikoloonia kandmiseks reagendiga immutatud riba osale külviaasa, siis ei tohi see olla metallist
- Kasutatud testiriba aseta kollasesse erimärgistusega prügikotti
- Tulemuse hindamisel järgi testi tootja juhiseid. Test on positiivne, kui oksüdaasreagendiga kokku puutunud kultuur testribal muutub lillakassiniseks või siniseks (joonis 6 vasakpoolsel testiribal). Testi tulemus on negatiivne, kui testriba oksüdaasreagendiga immutatud osa värvus ei muutu (joonis 6 parempoolsel testiribal).

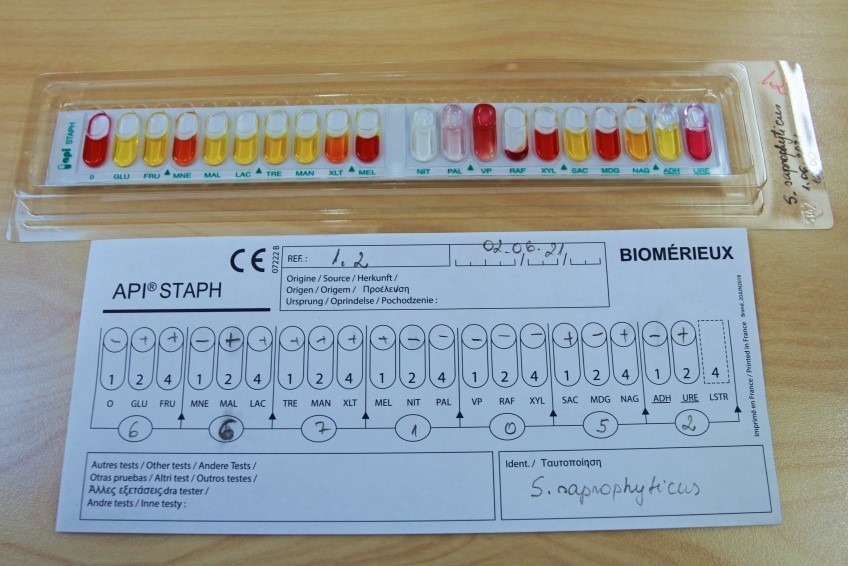
2.1.7.6. API® testsüsteemi põhimõte
API® testsüsteem on mitteautomaatne bakterite/seente liigi tasemel biotüpiseerimise süsteem. See koosneb inkubatsiooni karbist ja mitmetest mikrokatsutitest, milles on erinevad dehüdreeritud subtraadid bakterite/seente biokeemilise aktiivsuse määramiseks ning reaktiivide kompektist. Sobiva API® testi valimise eelduseks on vähemalt seente ja bakterite eristamine ja bakteri rakuseina tüübi kindlaksmääramine Grami järgi värvimisega ja/või spetsiifiliste testide tegemine. API® testi mikrokatsutites olevate substraatide inokuleerimiseks valmistatakse kindlas kasvufaasis olevast bakteri või seene puhaskultuurist kindla optilise tihedusega (mikroobide arvukusega) suspensioon. Mikroobi suspensiooni optiline tihedus mõõdetakse densitomeetriga. Peale mikrokatsutite inokuleerimist kultuure inkubeeritakse ja hinnatakse tulemused. Tulemustele antakse numbrilised väärtused ja saadakse unikaalne kood, mis sisestatakse vastava API® testi programmi. Programm võrdleb numbriliste väärtuste abil testiga kindlaks tehtud tunnuseid varem klassifitseeritud mikroobide samade tunnustega. Võrdlemise tulemusel leiab programm etalontüve ja uuritava bakteri vahelise sarnasuse koefitsiendi (protsendi). Tunnuseid saab võrrelda ka API juhendis oleva tabeli alusel manuaalselt.
Vajalikud ettevalmistused
Inkubaator peab olema eelsoojendatud 37 oC-ni
Kontrolli originaalpakendilt API® testribade säilivuskuupäeva
Soojenda külmkapist võetud API® testribad toatemperatuurile
Kõik vajalikud vahendid paiguta lauale töö tegemiseks sobivas järjekorras
- API® testi tootjapoolne juhend
- Ühekordsed steriilsed külviaasad
- Statiiv katsutitele
- Katsuti steriilse füsioloogilise lahusega
- Optilise tiheduse mõõtja (densitomeeter)
- Vorteks – segaja
- API® testriba
- API® testriba läbipaistvast plastikust inkubatsiooni karp
- Ühekordsed steriilsed Pasteuri pipetid
- Mineraalõli
- Tilgapudel destilleeritud veega
- Söötmed uuritavate kultuuridega
- Kollane erimärgistusega prügikott ja kollane erimärgistusega läbimatu konteiner teravatele ja lõikavatele vahenditele (näiteks alusklaasidele)
API® testi tegemine
- Mõõda densitomeetriga katsutis oleva füsioloogilise lahuse algtihedus ning märgi see üles
- Tee konkreetse API® testi jaoks vajaliku tihedusega mikroobi suspensioon: API® 20 E ja API® Staph 0,5 MacFarlandit, API® Candida 3,0 MacFarlandit:
- Võta steriilse külviaasaga uuritava bakteri kultuuri ning suspendeeri see füsioloogilisse lahusesse
- Sega suspensiooni vorteks – segajal
- Mõõda densitomeetriga suspensiooni optiline tihedus
- Vajadusel lisa suspensioonile veel uuritavat kultuuri või steriilset füsiloogilist lahust, et saavutada nõutud tihedus. Kui vaja, korda eelnevaid etappe
- Aseta kasutatud külviaas kollase erimärgistusega prügikotti
- Markeeri API® testribade inkubatsioonikarbi välja ulatuv osa vajalike andmetega (proovi identifitseerimise märgis, uuringu tegija nimi, kuupäev jm)
- Kanna tilgapudeliga API® testriba inkubeerimise karbi põhja (süvenditega pool) destileeritud vett, et vältida inkubeerimise käigus mikrokatsutitesse kantud suspensiooni kuivamist
- Aseta testriba niisutatud inkubatsiooni karbi põhja
- Täida Pasteuri pipetti kasutades API® testribal olevad mikrokatsutid (joonis 7) eelnevalt valmistatud mikroobisuspensiooniga vastavalt tootja juhistele
- NB! Mikrokatsutitesse ei tohi täitmise protsessis tekkida õhumulle
- Aseta kasutatud Pasteuri pipett kollasesse erimärgistusega prügikotti
- Sulge inkubatsiooni karp kaanega
- Aseta testsüsteem termostaati 37 oC juurde 24 tunniks
2.1.7.7. Külv sapi-eskuliin agarile
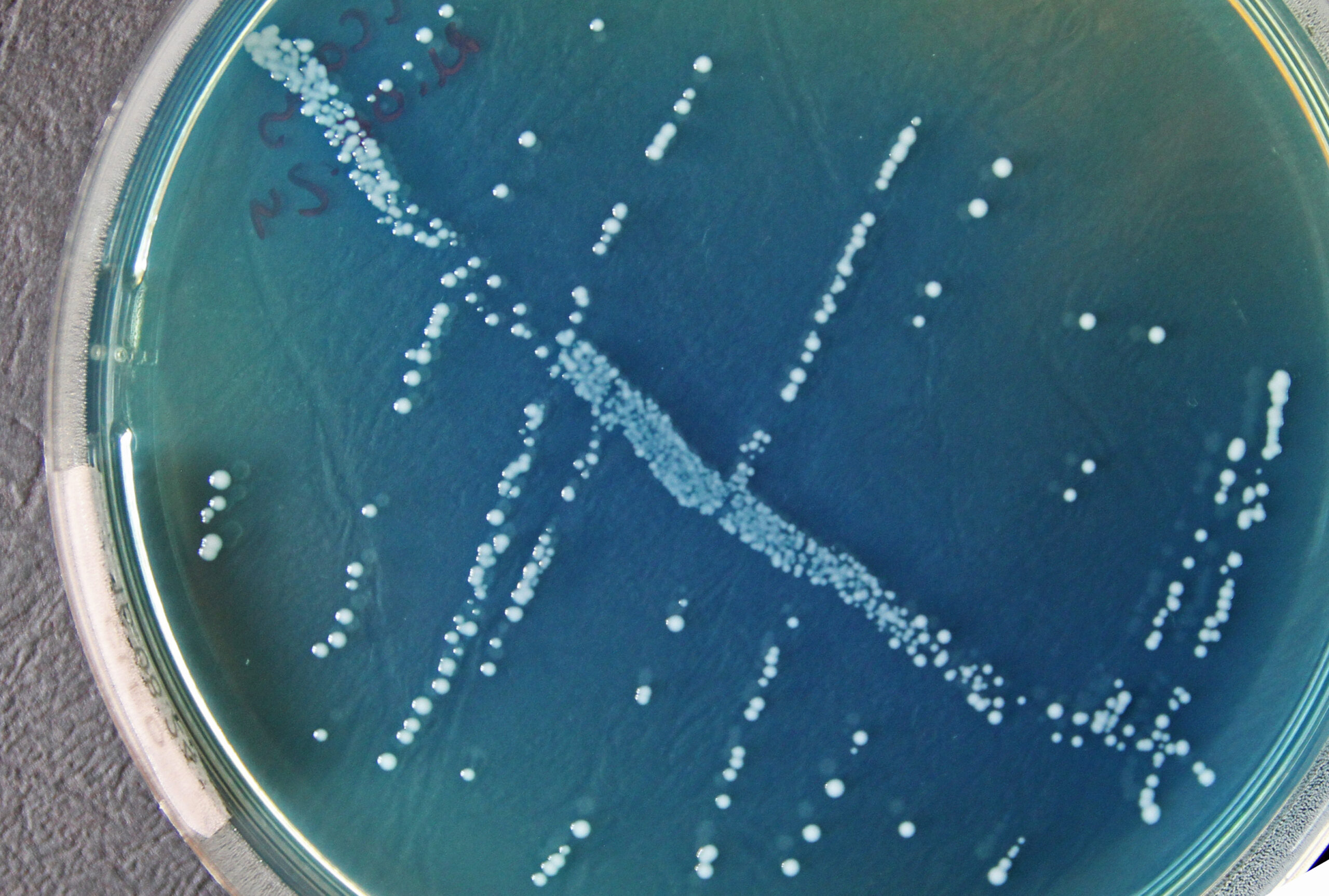
Uropatogeenide diagnostikas on oluline eristada Grampositiivsete katalaasnegatiivsete kokkide perekondi Streptococcus spp ja Enterococcus spp esindajaid. Sapi-eskuliini agar sisaldab sappi ja eskuliini, viimast on võimelised sapi juuresolekul hüdrolüüsima vaid enterokokid ja D gruppi kuuluvad streptokokid. Hüdrolüüsi produktid reageerivad söötmes olevate raua ioonidega, muutes söötme mustjaspruuniks ja bakterite pesad mustjashallikaks.
Vajalikud ettevalmistused
Temostaat peab olema eelsoojendatud 37 oC
Kõik vajalikud vahendid paiguta lauale töö tegemiseks sobivas järjekorras
- Toatemperatuurini soojenenud ka kvaliteetne sapi-eskuliin agar
- Uuritava kultuuriga Petri tass
- Ühekordne 1 µl külviaas
- Marker
- Kollane erimärgistusega prügikott, teravatele ja lõikavatele vahenditele (näiteks alusklaasidele) kollane erimärgistusega läbimatu konteiner
Külvi tegemine
- Markeeri sapi-eskuliini agariga Petri tass kuupäeva-, proovinumbri- ning oma nimega
- Võta CLED agarilt 1 μl külviaasaga uuritavat kultuuri
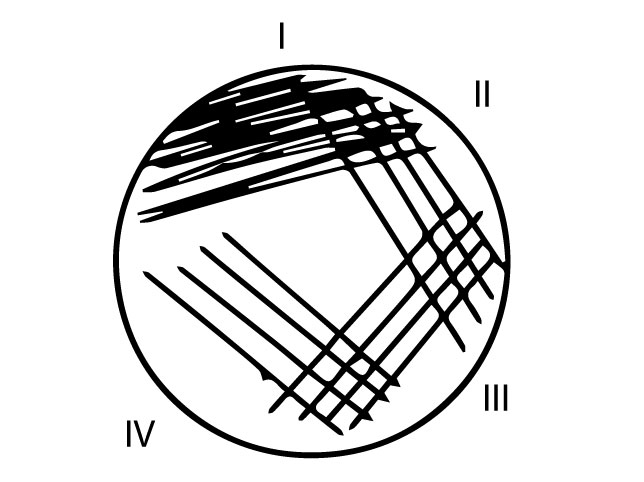
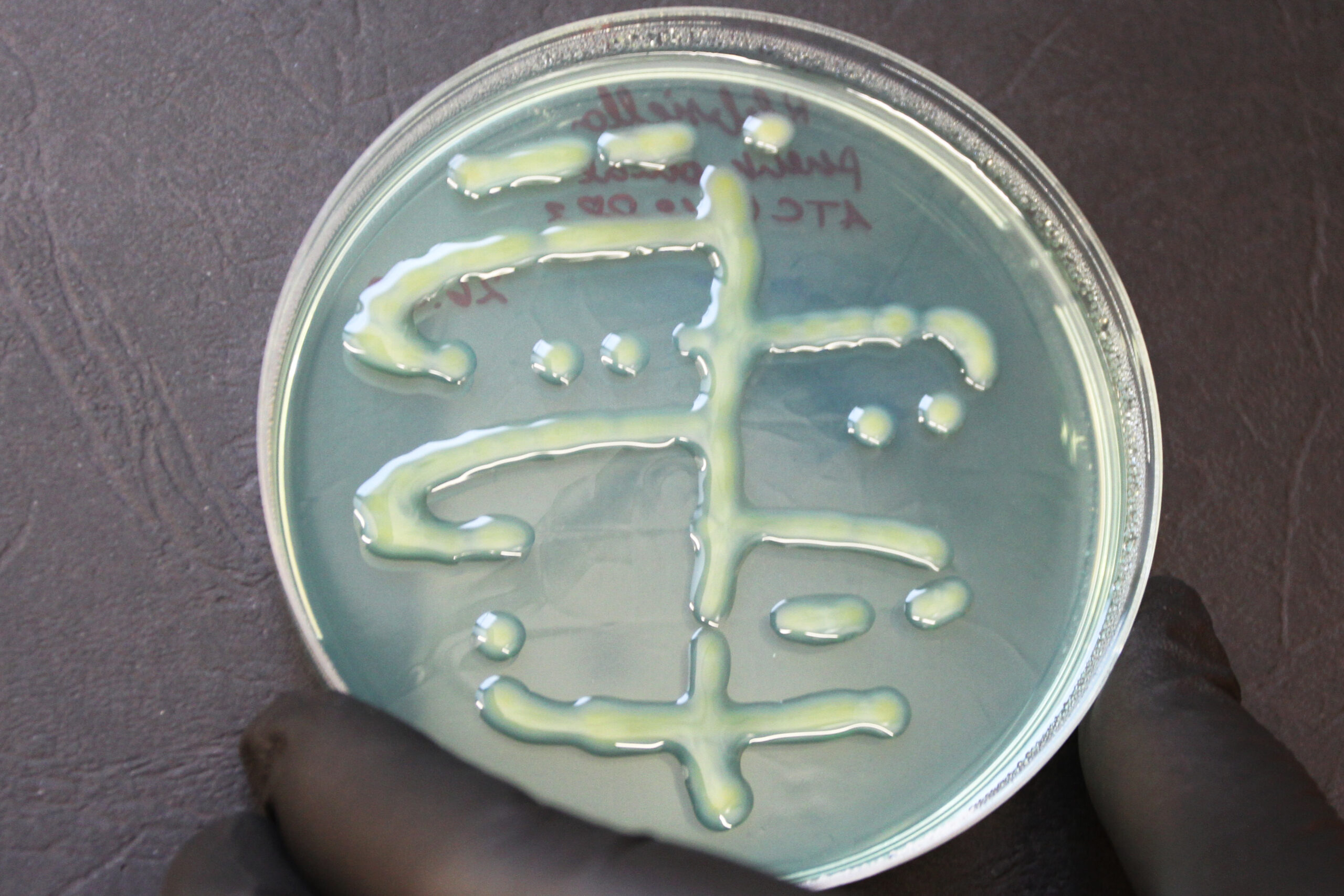
- Kanna uuritav kultuur poolkvantitatiivse külvina sapi-eskuliini agarile (Joonis 8). Toimi järgmiselt:
- Võta 1 µl külviaasaga 4-5 uuritavat pesa CLED agarilt ja kanna materjal edasi tagasi liigutustega laiali ühe kolmandiku tassi pinnale (Joonis 8 I sektor)
- Vaheta külviaasa pool, puuduta I sektorit ja tõmba neli paralleelset joont vasakult paremale (Joonis 8 II sektor)
- Keera tassi, võta steriilne külviaas, puuduta II sektorit ja tõmba neli paralleelset joont vasakult paremale (Joonis 8 III sektor)
- Keera tassi. Vaheta külviaasa pool, puuduta III sektorit ja tõmba neli paralleelset joont vasakult paremale (Joonis 8 IV sektor)
- Aseta kasutatud külviaasad kollasesse erimärgistusega prügikotti
- Aseta sapi-eskuliini agariga Petri tass termostaati 37 oC juurde 24 h nii, et tassi põhi oleks ülevalpool
2.1.8. Kolmas uuringupäev
2.1.8.1. API® testi hindamine
Vajalikud ettevalmistused
- Võta külmikust toatemperatuurini soojenema vajalikud reagendid
- Võta termostaadist sinna eelneval päeval inkubeerima pandud API® testsüsteem
- Ava arvutis programm APIweb, seejärel vali loetelust sobiva nimetusega API® test
Vajalikud vahendid
- API® testi reagendid
- Tootjapoolne juhend API® testi hindamiseks
- Uuritava mikroobikultuuriga API® testribad
- Hindamislehed testi numbrikombinatsiooni (koodi) saamiseks
Hindamiskäik
- Tootjapoolse juhendi põhjal lisa mikrokatsutitele vajalikud reagendid ja hinda tulemusi vastavalt tootjapoolsele tabelile kas negatiivseteks või positiivseteks
- Tulemused kanna hindamislehele, kus positiivsetele tulemustele vastab mingisugune arvväärtus
- Positiivsetele tulemustele vastavad arvväärtused summeeritakse kolme kaupa, see summa kirjutatakse hindamislehele vastava kolmiku all olevasse lahtrisse
- Summadest saadud numbritest moodustub uuritavale bakterile iseloomulik kood (Joonis 9)
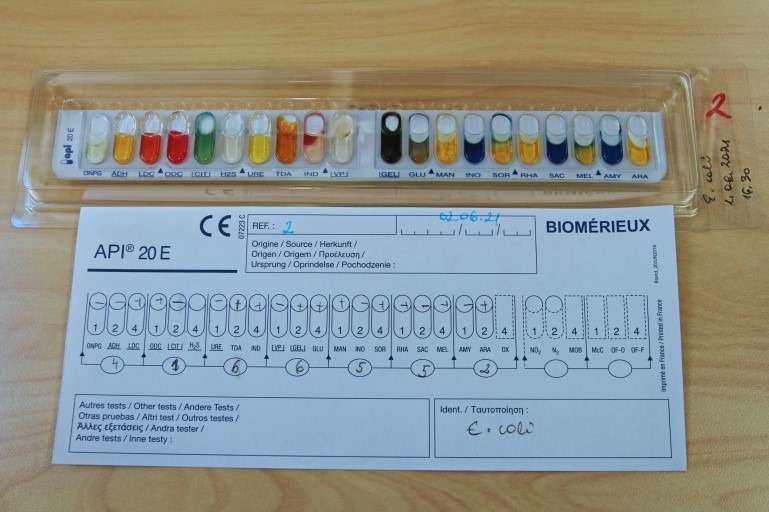
- Kanna summadest moodustunud kood arvutis olevasse hindamisprogrammi, mis seejärel väljastab sisestatud kombinatsioonile vastava mikroobi ladinakeelse nime ning tõenäosuse (protsendi), mis iseloomustab, kui suurel määral uuritava mikroobi biokeemilised tunnused langevad kokku klassifitseeritud mikroobi vastavate tunnustega
- Samastamise tulemuseks on mikroob, mille kokkulangevusprotsent on kõige kõrgem
- Tootjapoolne juhend sisaldab tavaliselt tabelit, milles on toodud mikroobide erinevate liikide biokeemilised omadused teatud tõenäosusega (%), tabeli analüüsimisel saab samastatava kultuuri tulemusi täpsustada või manuaalselt, programmi abita samastada
2.1.8.2. Kasvude hindamine sapi-eskuliini agaril
Kasvude hindamine
- Pärast 24 h inkubeerimist võta termostaadist välja sapi-eskuliini agariga külv.
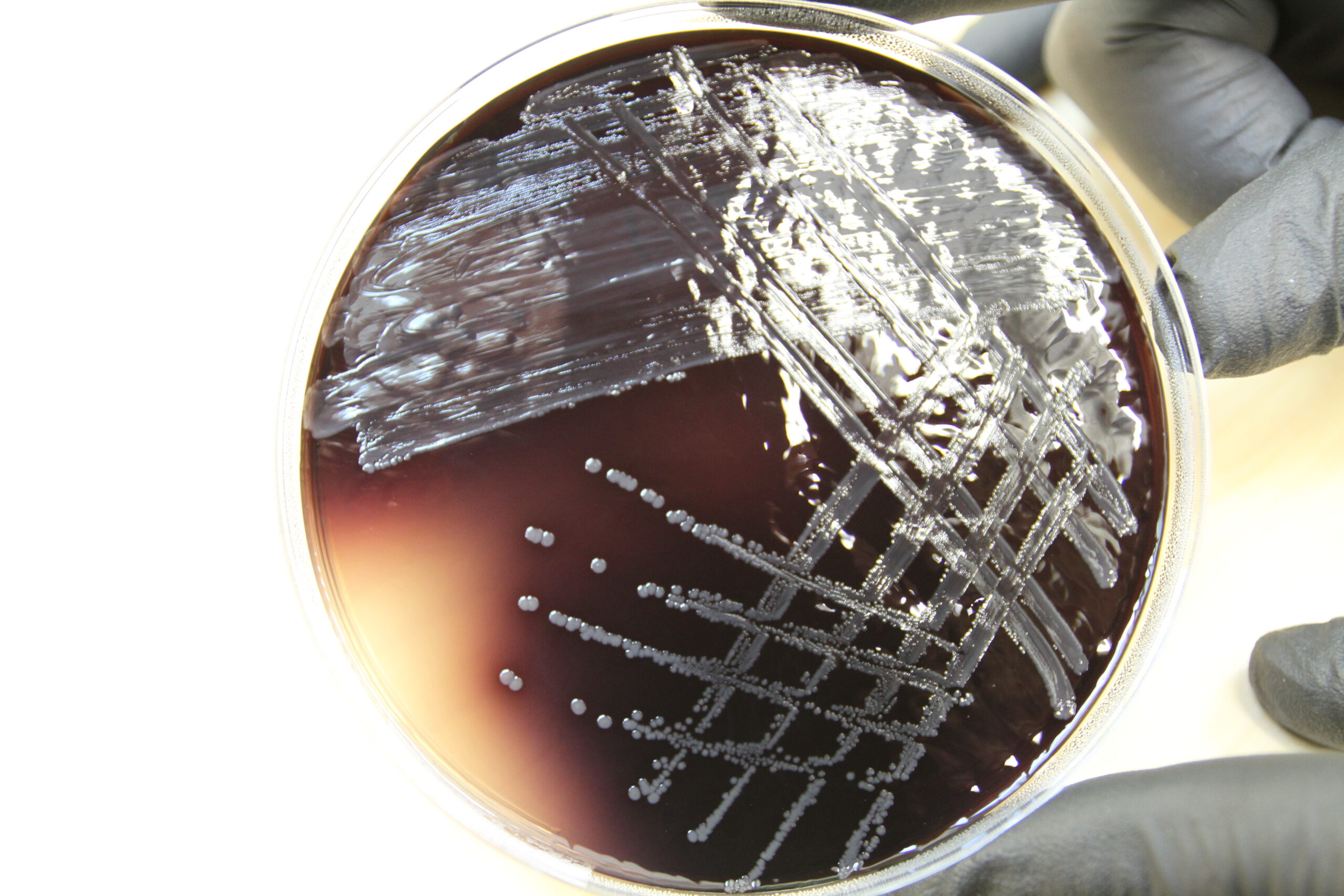
- Hinda tulemusi. Hallikasmustjaid väikeseid ~ 1 mm suurused pesad, mis on värvinud söötme mustjaspruuniks, iseloomustavad Enterococcuse spp kasvu (Joonis 10).
2.1.9. Enam esinevad uropatogeenid
Primaarsed UTI tekitajad on enterobakterite hulka kuuluv Escherichia coli ja kokkidest Staphylococcus saprophyticus, teised võimalikud UTI tekitajad on Proteus spp ja Klebsiella spp ning Enterococcus faecalis ja pärmseen Candida albicans
2.1.9.1. Enterobakterid
Escherichia coli
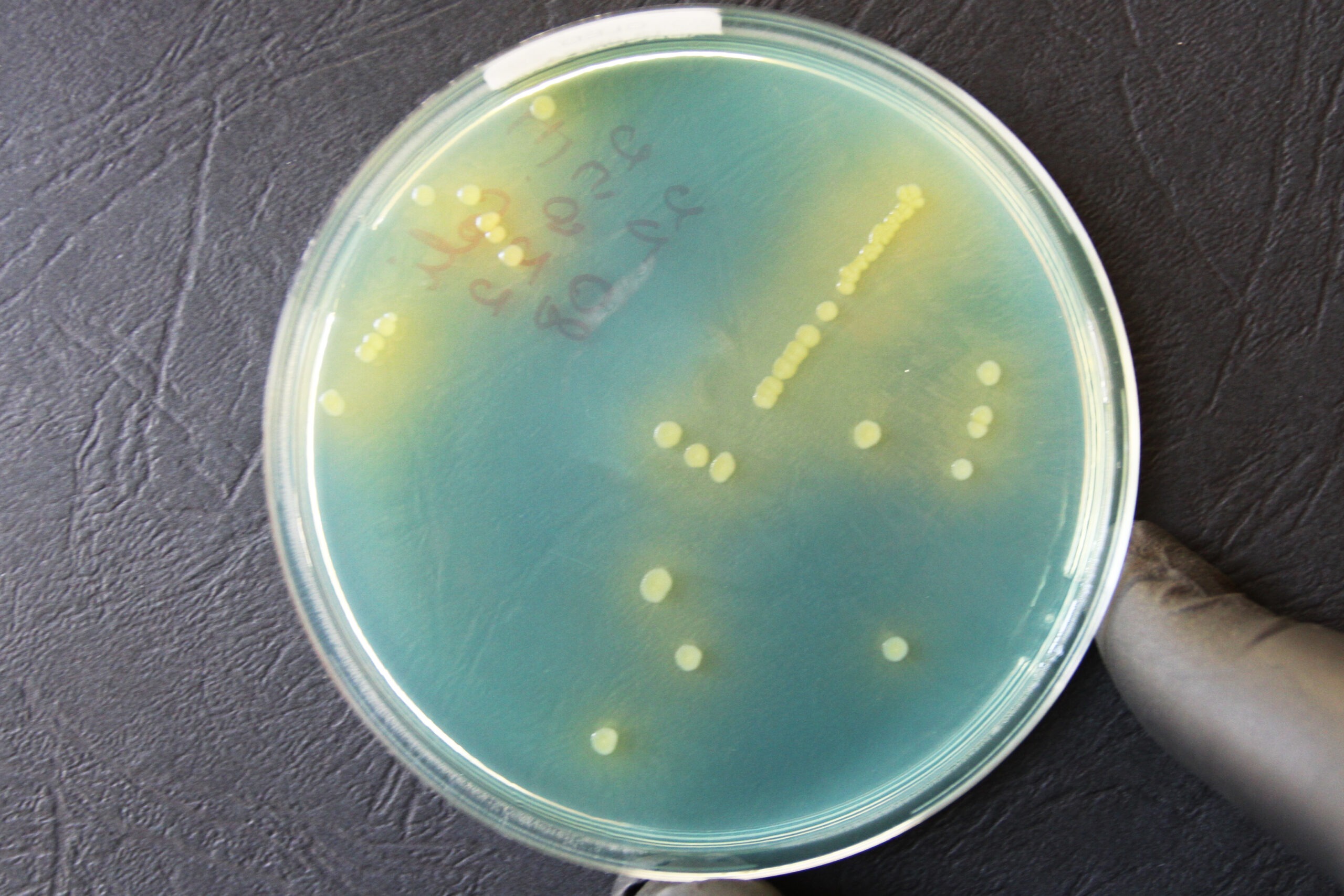
E. coli’le iseloomulikud pesad CLED agaril on kollased (laktoos-positiivsed), keskosas veidi tumedamad, opaaksed, ~1‒1,5 mm suurused (Joonis 11).
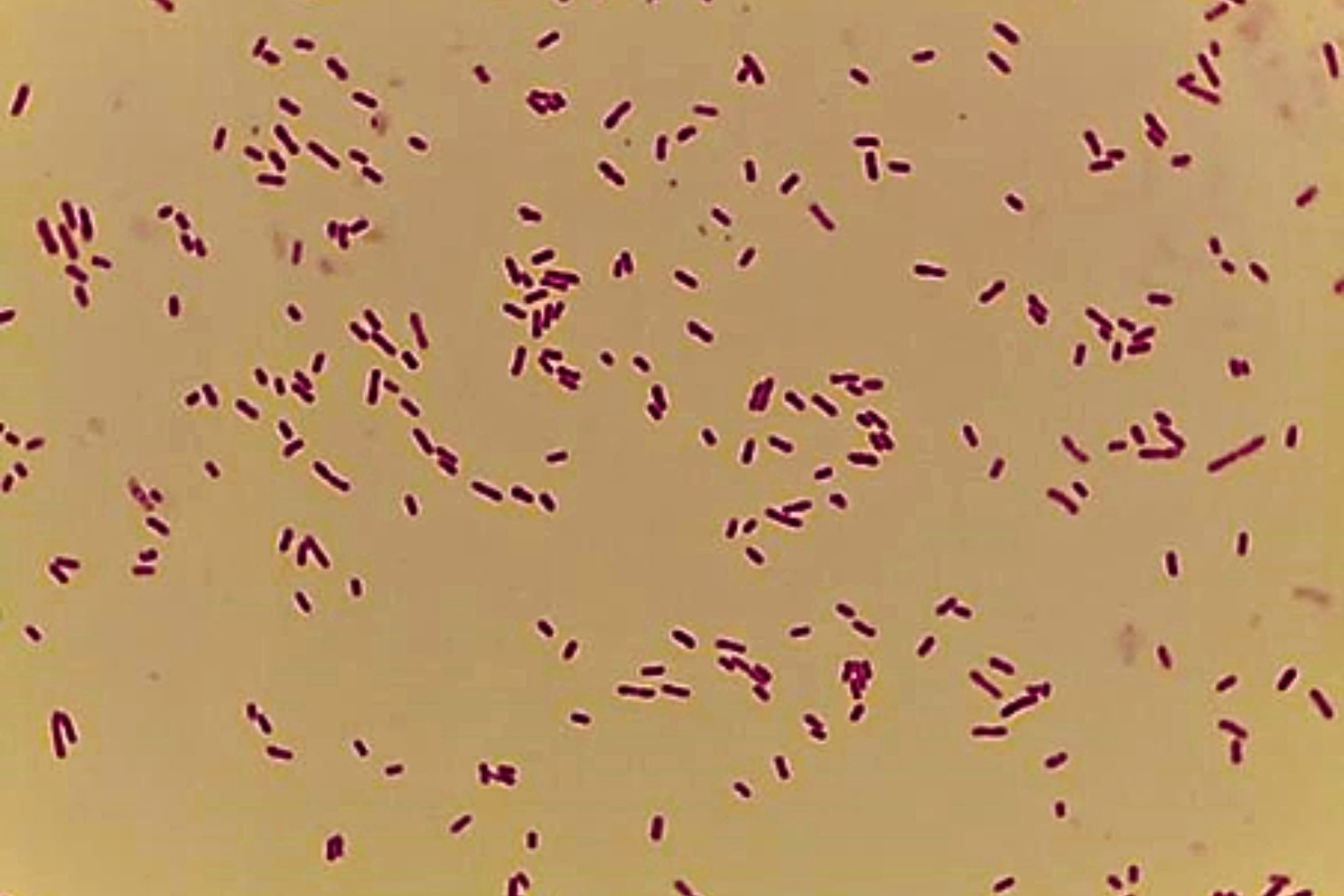
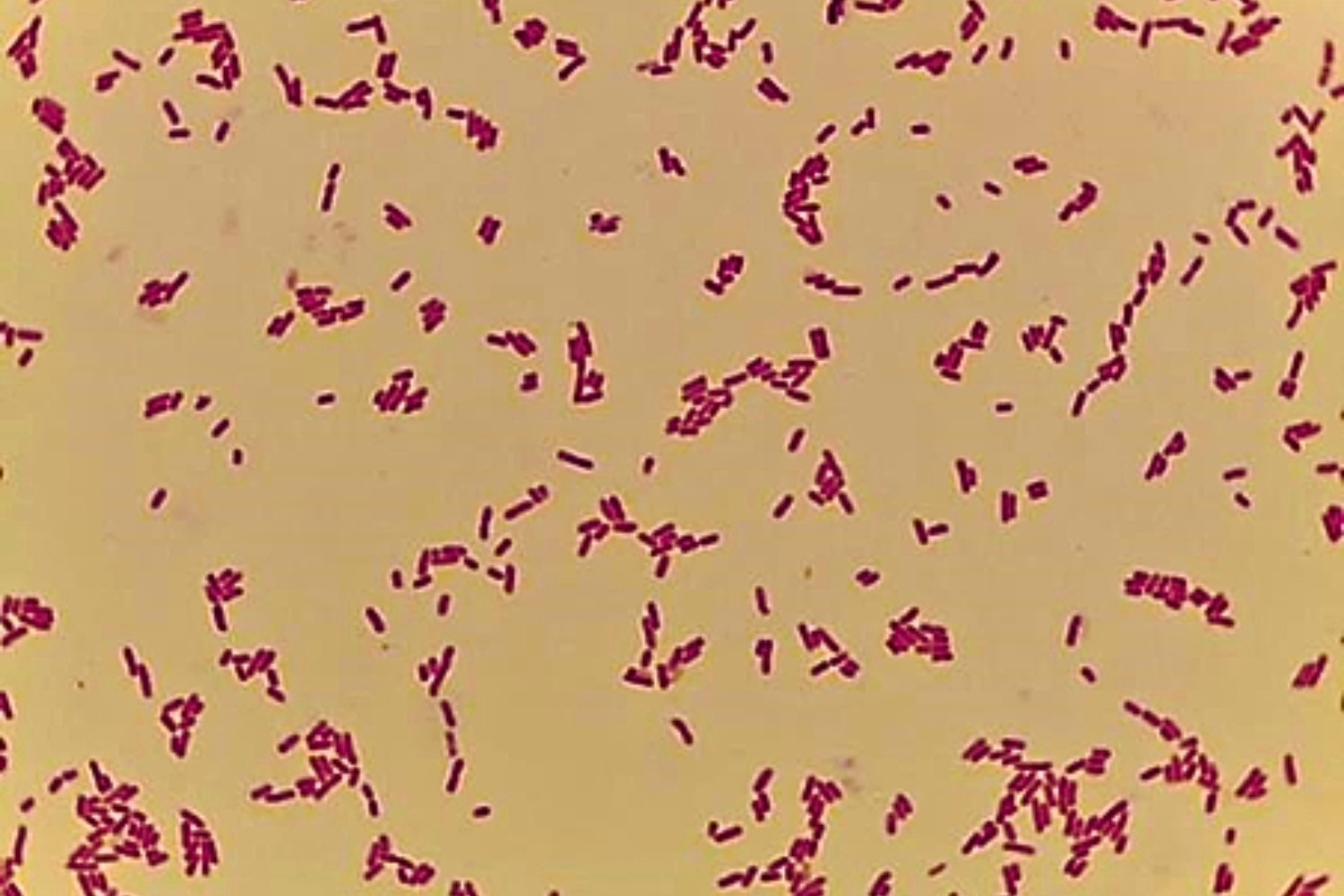
Gram’i värvinguga preparaadis on näha punaseid Gramnegatiivseid 0,5–0,8×1,0–2,0 µm suuruseid pulkbaktereid (Joonis 12).
E. coli’le on iseloomulik negatiivne oksüdaasi reaktsioon.
Biokeemiliseks samastamiseks teha API® test. E. coli määramiseks kasutada Enterobacteriaceae sugukonna ja teiste vähenõudlike Gram-negatiivsete mikroobide identifitseerimiseks mõeldud testsüsteemi API®20E. E. coli’le iseloomulikku API® testi tulemust kajastab joonis 13.
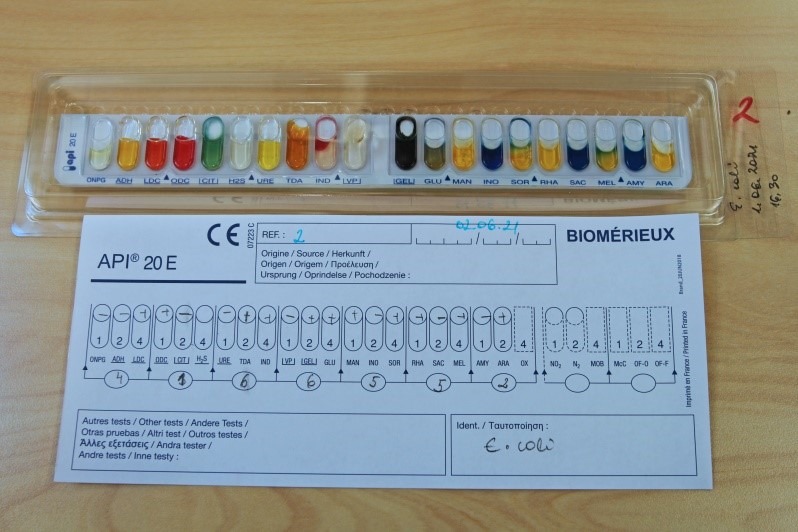
Proteus spp
Iseloomulikud pesad CLED agaril: limased, sinakasrohelised (laktoos-negatiivsed), ~ 1 mm suurused pesad. CLED agaril puudub Proteus spp’le iseloomulik roomav kasv (Joonis 14).

Gram’i värvinguga preparaadis on näha punaseid Gramnegatiivseid ~2 µm suuruseid pulkbaktereid (Joonis 15).
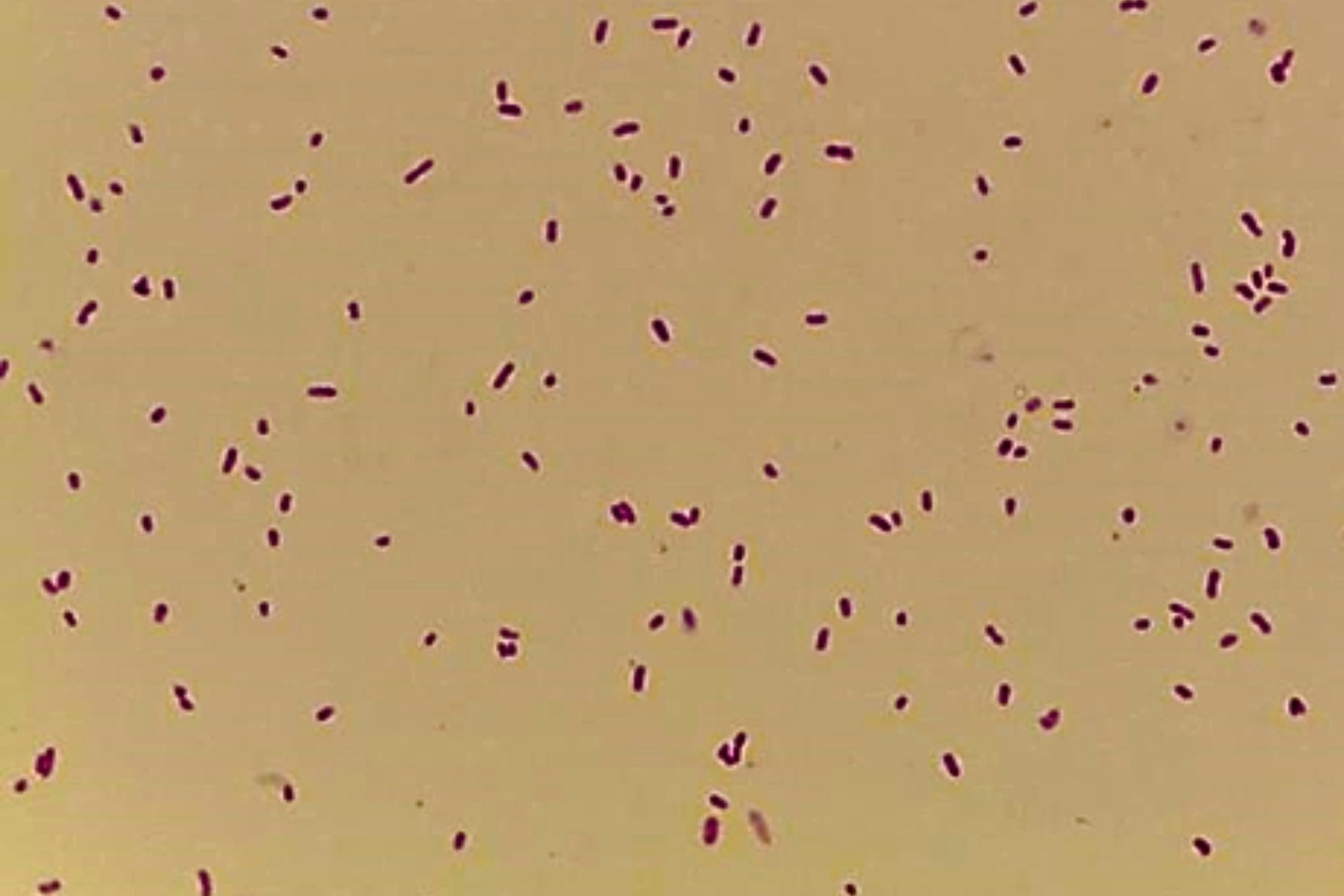
Proteus spp´le on iseloomulik negatiivne oksüdaasi reaktsioon.
Biokeemiliseks samastamiseks teha API® test. Proteus spp määramiseks kasutada Enterobacteriaceae sugukonna ja teiste vähenõudlike Gram-negatiivsete mikroobide identifitseerimiseks mõeldud testsüsteemi API® 20 E. Proteus vulgaris’le iseloomulikku API® testi tulemust kajastab joonis 16.
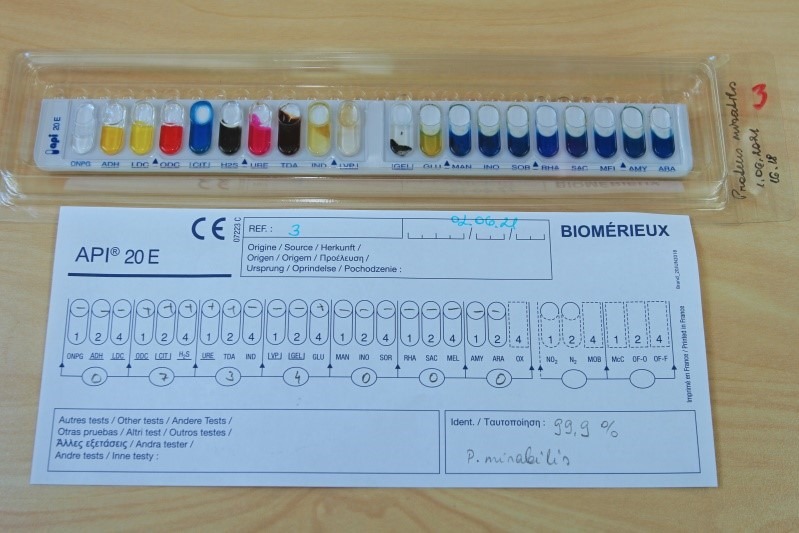
Klebsiella spp
Iseloomulikud pesad CLED agaril on suured, väga limased, hästi võlvunud, võivad olla nii kollased (laktoos-positiivsed) kui ka siniseid (laktoos-negatiivsed) (Joonis 17).
Gram’i värvinguga preparaadis on näha punaseid Gramnegatiivseid lühikesi ja pakse pulkbaktereid suurusega 0,5–0,8 μm x 1‒2 μm, harva võib raku ümber märgata ka kihnu olemasolust põhjustatud õrna halo (Joonis 18).
Klebsiella spp on iseloomulik negatiivne oksüdaasi reaktsioon.
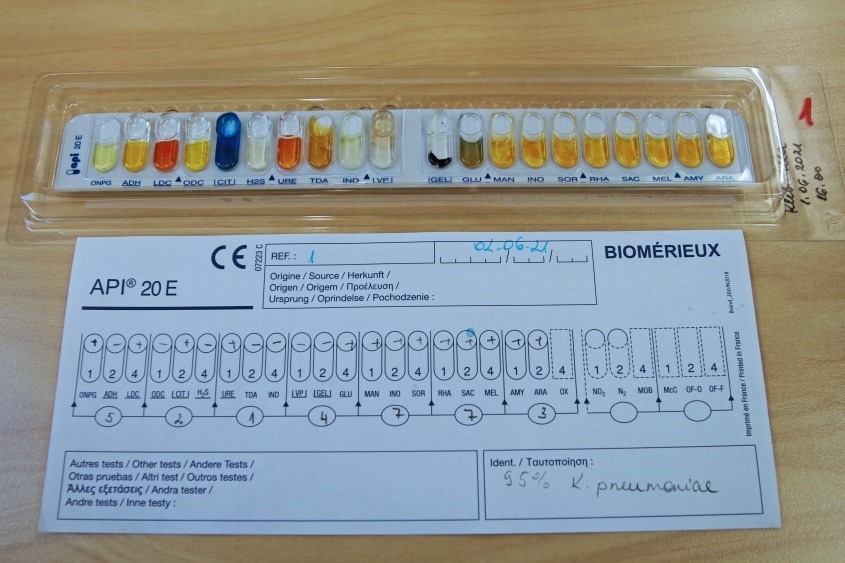
Biokeemiliseks samastamiseks teha API® test. Klebsiella spp määramiseks kasutada Enterobacteriaceae sugukonna ja teiste vähenõudlike Gram-negatiivsete mikroobide identifitseerimiseks mõeldud testsüsteemi API® 20 E. Klebsiella pneumoniae’le iseloomulikku API® testi tulemust kajastab joonis 19.
2.1.9.2. Kokikujulised bakterid
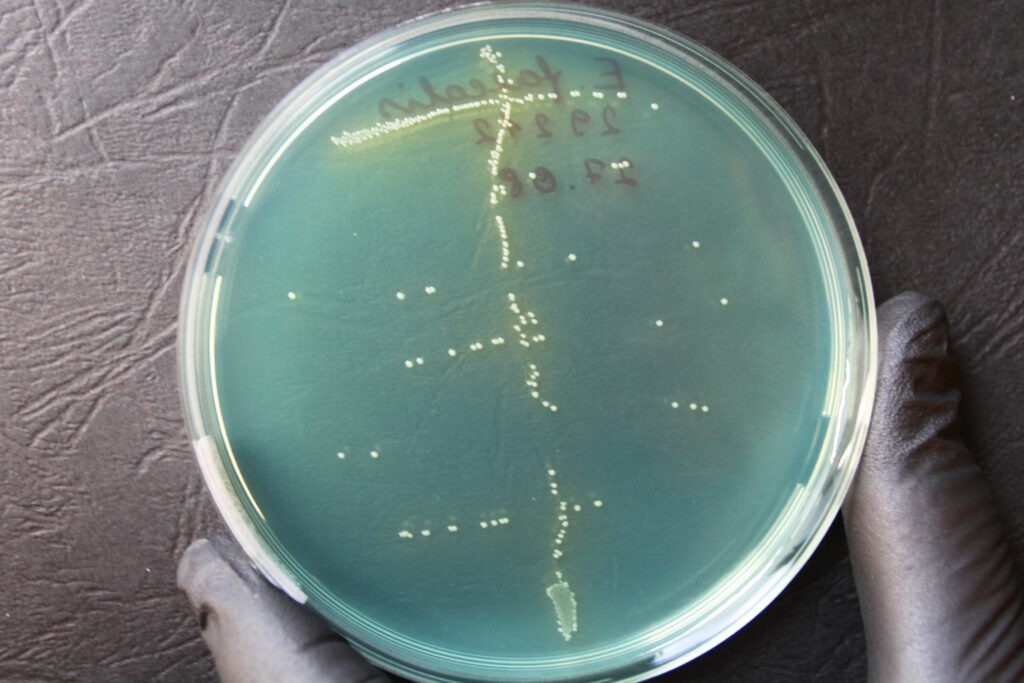
Staphylococcus saprophyticus
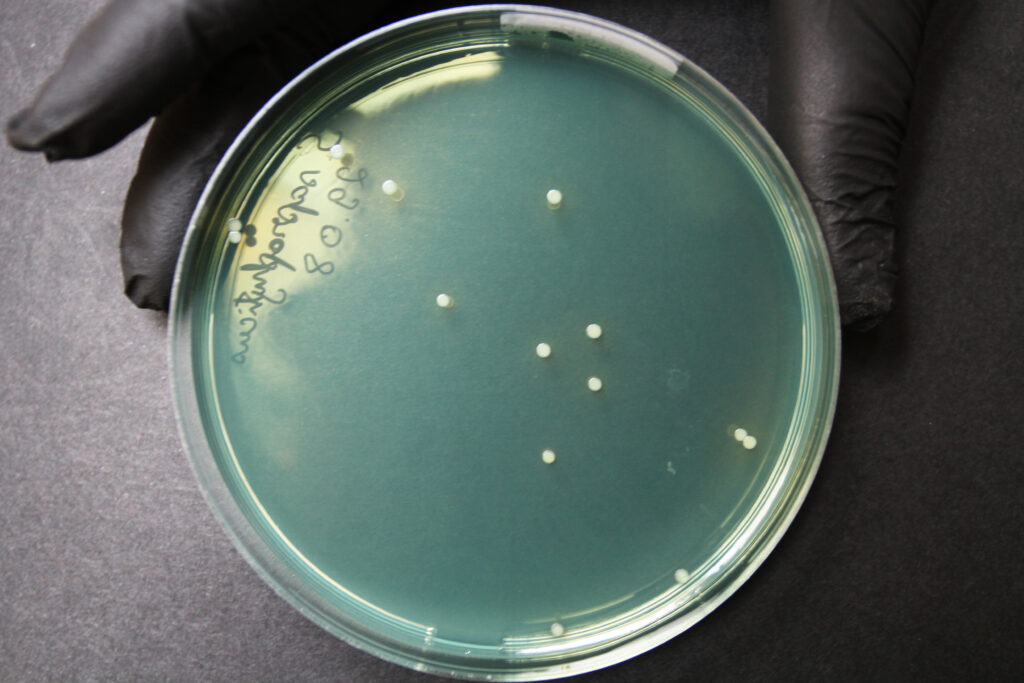
Iseloomulikud pesad CLED agaril on väiksed, valged kuni kollased (laktoos-positiivsed). Söötme pind on samuti kollane (Joonis 20).
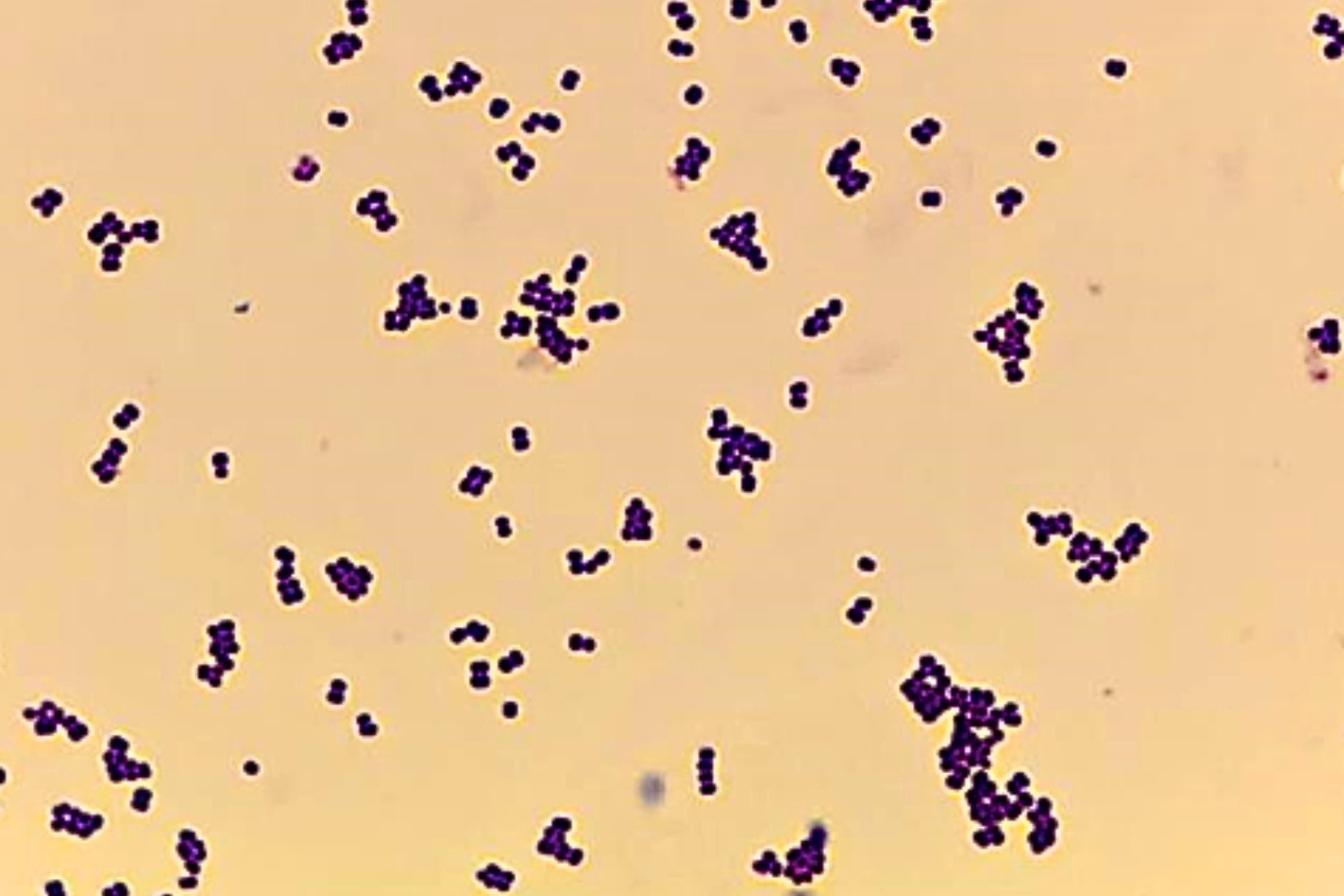
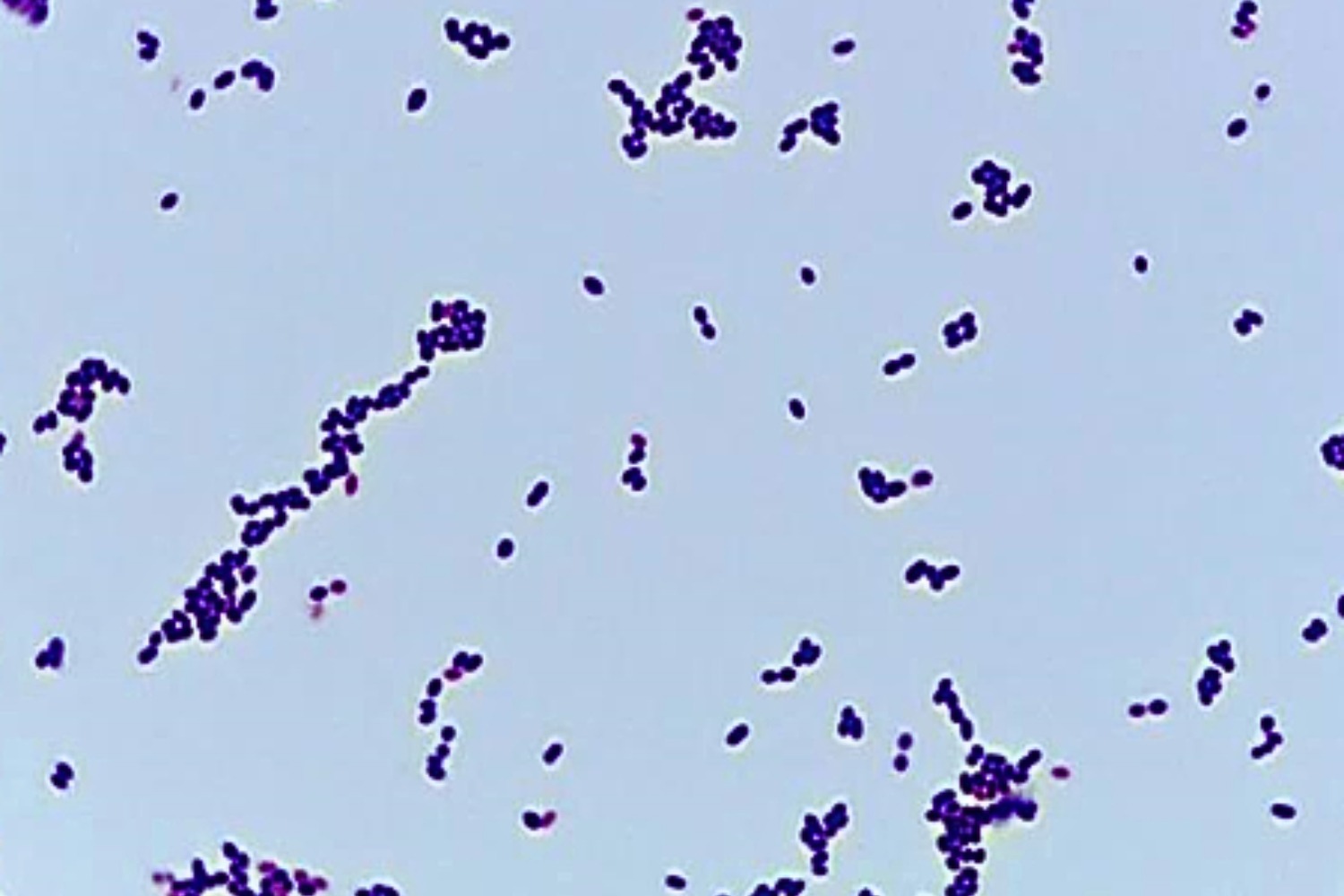
Gram’i preparaadis on näha siniseid Grampositiivseid kobaratena asetsevaid 0,5–1,5 µm läbimõõduga kokke (Joonis 21).
S. saprophyticus’le on iseloomulik positiivne katalaasi reaktsioon.
Biokeemiliseks samastamiseks teha API® test. S. saprophyticus’e määramiseks kasutada Staphylococcus perekonda kuuluvate mikroobide identifitseerimiseks mõeldud testsüsteemi API® Staph. S. saprophyticus’le iseloomulikku API® testi tulemust kajastab joonis 22.
Enterococcus spp
CLED agaril on Enterococcus spp´le omased laktoos-positiivsed kollased pesad kollasel söötme pinnal. Pesad on ümarad, väiksed umbes 0,5–1 mm suurused, pisut limased (Joonis 23).
Gram’i värvinguga preparaadis on näha siniseid Grampositiivseid kokke. Kujult on nad ümarad ovaalsed ning võivad asetseda üksikult, paarikaupa või väikeste ahelatena (Joonis 24).
Enterococcus spp annab negatiivse katalaasi testi.
Enterococcus spp esineb sapi-eskuliini agaril väikeste 0,5–1 mm suuruste mustjashallide pesadena, värvides ka söötme mustjaspruuniks, näha on iseloomulikke mustjashallikaid pesi mustjaspruunil taustal (Joonis 10).
2.1.9.3. Pärmseened
Candida albicans
Iseloomulikud pesad CLED agaril on kumerad, kuivad, pikemaajalisel inkubeerimisel tähekujulised, massiivse kasvu korral esineb pärmi lõhn (Joonis 25).
Gram’i värvinguga preparaadis on näha siniseid suuri, ovaalseid rakke, mis on värvunud nagu Grampositiivsed rakud, esineda võib pungumist (Joonis 26).
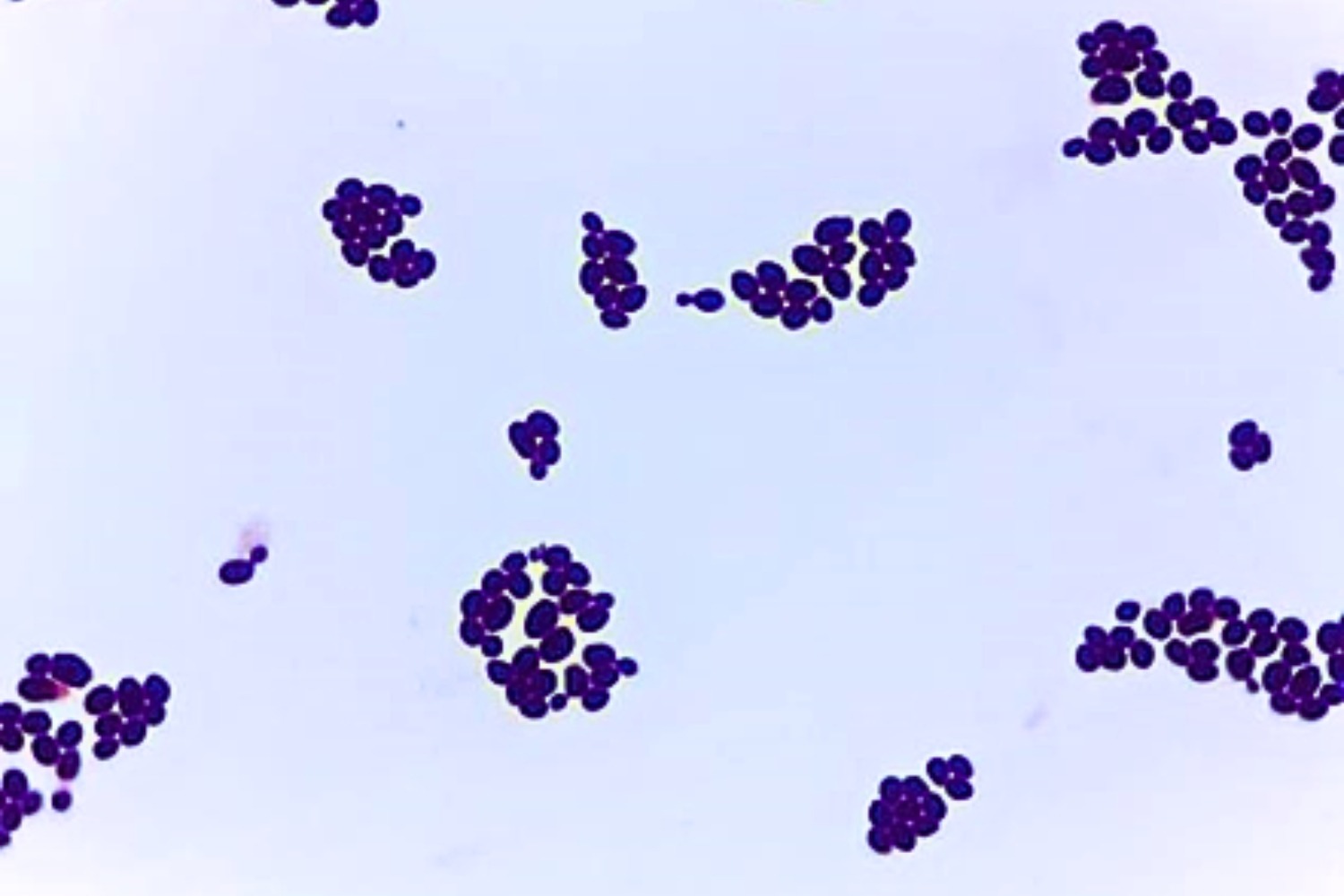
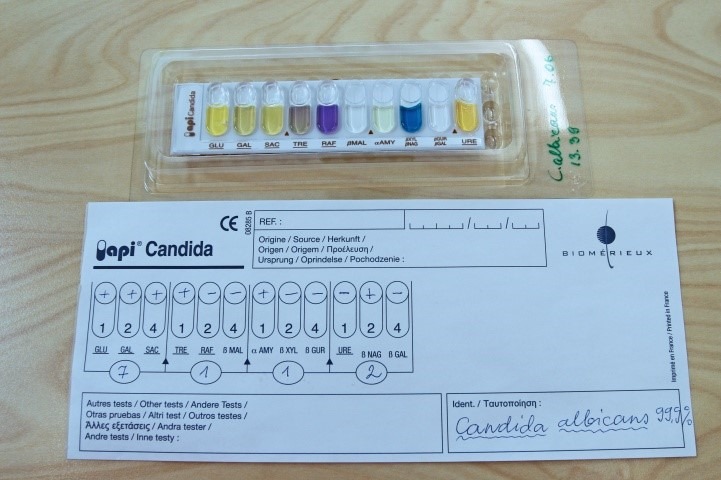
Biokeemiliseks samastamiseks teha API® test. C. albicans’i määramiseks kasutada pärm seente identifitseerimiseks mõeldud testsüsteemi API® Candida. C. albicans’le iseloomulikku API® testi tulemust kajastab Joonis 27.
2.1.10. Ülesanne
Koosta juhendi põhjal kõiki võimalusi arvesse võttev algoritm (skeem, samm-sammuline tegevusjuhis, juhend, eeskiri, reeglistik) uropatogeenide isoleerimise ja samastamise kohta ning märgi sellele kvaliteedi kontrolli kohad.