| Tartu Tervishoiu Kõrgkool Bioanalüütika labori kvaliteedikäsiraamat | |||
| Koostas: | Anneli Karus | Kuupäev: | 05.01.2015 |
| Kinnitas: | Anneli Raave-Sepp | Kuupäev: | 05.01.2015 |
1.10.1. MEETODI ULATUS
- Käesolev juhend on mõeldud ABO- ja Rh-veregrupisüsteemi kuuluvuse määramiseks Tartu Tervishoiu Kõrgkooli hematoloogia õppelaboris.
- Käesoleva juhendi järgi toimub ABO-veregrupi määramine otsese ja pöördreaktsiooni kaudu kasutades geeltehnikat.
- Juhendi koostamisel on lähtutud ID-DiaClon ABO/D + Reverse grouping geelkaardi infolehest ning immuunhematoloogilisi uuringuid reguleerivatest õigusaktidest.
1.10.2. MEETODI KEHTIVUS
- Meetod kehtib kasutamiseks õppetöös: JAH
- Meetod kehtib kasutamiseks teadusuuringute teostamisel: JAH
- Meetod kehtib kliiniliseks kasutamiseks patsiendi proovide teostamisel: EI
1.10.3. TESTI PÕHIMÕTE
- Inimese ABO-veregrupp on määratletud erütrotsüütide pinnal olevate A, B, H antigeenide ning vereplasmas sisalduvate ”loomulike” antikehade anti-A ja anti-B kaudu.
- Rh (D) kuuluvuse määrab D antigeeni olemasolu erütrotsüütidel.
- ABO-veregrupp ja RH(D) tuleb määrata: rasedatel; patsiendile enne vereülekande tegemist.
1.10.4. PROOVIMATERJAL JA SELLE SÄILITAMINE
- Analüüsiks võtta veeniveri EDTA katsutisse (lilla kork) või CPD-A katsutisse (geelita seerumikatsuti). NB! Geeliga seerumikatsuti analüüsi teostamiseks ei sobi!
- Kui patsiendilt ei saa võtta veeniverd, tehakse analüüsid kapillaarverest.
- Proovimaterjal ei tohi olla hemolüütiline.
- Analüüsi teostamiseks kasutada võimalikult värsket verd. Vajadusel saab verd säilitada külmkapi temperatuuril (+2 kuni +8 ̊C) kuni kaks (2) ööpäeva.
1.10.5. UURINGU TEOSTAMISEKS VAJALIK APARATUUR JA TÖÖVAHENDID
- Tsentrifuug proovimaterjali (vere) tsentrifuugimiseks.
- ID-tsentrifuug geelkaartide tsentrifuugimiseks (Joonis 5).
- Automaatpipetid (50 μl , 25 μl , 10 μl) ja vastavad pipetiotsikud.
- Geelkaartide hoidmiseks vastav alus (Joonis 1). Kaarte tuleb hoida püstiasendis!
- Tühjad katsutid (plasma või seerumi eraldamiseks ning erütotsüütidest suspensiooni valmistamiseks).
- Pasteuri-pipetid.
- ID-dispenser (Liss lahuse doseerimiseks 500 μl).
- Taimerkell.
- Isikukaitsevahendid (kummikindad jne).

1.10.6. UURINGU TEOSTAMISEKS VAJALIKUD REAGENDID
- Geelkaart ID-Card: DiaClon ABO/D + Reverse Grouping (Joonis 1).
- Säilitatakse püstiasendis toatemperatuuril (+18 kuni +25 ̊C).
- Säilivusaeg on märgitud tootele.
- Säilivuse tagamiseks peavad kaardid olema õhutihedalt fooliumribaga kaetud.
- Standarderütrotsüüdid ID-DiaCell A1 ja B (Joonis 2).
- Säilitatakse külmkapi temperatuuril (+2 kuni +8 ̊C).
- Analüüside teostamiseks võetakse eelnevalt soojenema toatemperatuurile.
- Säilivusaeg on märgitud tootele.
- Liss2 lahus (ID-Diluent2) (Joonis 2).
- Säilitatakse külmkapi temperatuuril (+2 kuni +8 ̊C).
- Analüüside teostamiseks võetakse dosaatorpudelis Liss2 lahus eelnevalt soojenema toatemperatuurile.
- Säilivusaeg on märgitud tootele.
1.10.7. SISEMINE KVALITEEDIKONTROLL
- Kooli tingimustes antud metoodika puhul sisemist kontrolli ei rakendata.
- Meditsiinilabori tingimustes on sisemise kontrolli rakendamine kohustuslik.
1.10.8. TÖÖOHUTUS JA JÄÄTMEKÄITLUS
- Uuringus kasutatavaid proovimaterjale tuleb käidelda potensiaalselt nakkusohtliku materjalina. Kasutada tuleb isikukaitsevahendeid.
- Uuringu käigus tekkinud bioloogiliselt ohtlikud jäätmed kogutakse selleks spetsiaalselt ette nähtud konteinerisse.
- Kasutatavaid reagente tuleb käidelda vastavalt kemikaalide käitlemise juhistele.
1.10.9. TÖÖKÄIK
1.10.9.1. Ettevalmistus analüüsiks:
- Võta külmkapist välja uuringu teostamiseks vajalikud standarderütrotsüütide pudelid ja Liss2 lahus (Joonis 2) ja lase neil soojeneda toatemperatuurini.

- Tsentrifuugi patsiendi verekatsuti 10 minutit RCF 2000g juures.
- Pane statiivile valmis geelkaart (ühele patsiendile 1 kaart).
- Markeeri kaart patsiendi andmetega (nimi, kood vmt) ja analüüsi teostamise kuupäevaga.
- Kontrolli standarderütrotsüütide säilivusaega ja lahuse värvust ning sega pudeleid ettevaatlikult aga hoolikalt, et standarderütrotsüüdid seguneksid säilituslahusega. NB! Jälgi, et pudeli põhjas ei oleks sadet (Joonis 2).
- Pane patsiendi tsentrifuugitud verekatsuti statiivile.
- Võta patsiendi verekatsuti juurde kaks tühja patsiendi andmetega markeeritud katsutit.
- Eralda nendest ühte tühja katsutisse patsiendi vererakkudelt plasma või seerum.
- Teise tühja katsutisse doseeri ühe dispenseri vajutusega Liss2 lahust patsiendi erütrotsüütidest suspensiooni valmistamiseks (vt punkt 8.2.6.).
1.10.9.2. Geelkaardi kasutamine:
- Kontrolli, kas geelkaart (ID-Card: DiaClon ABO/D + Reverse Grouping) on vastavalt patsiendile markeeritud (patsiendi andmed ja uuringu kuupäev).
- Eemalda kaardi küvettide pealt ettevaatlikult fooliumriba nii, et viimane ots jääb kaardiga seotuks.
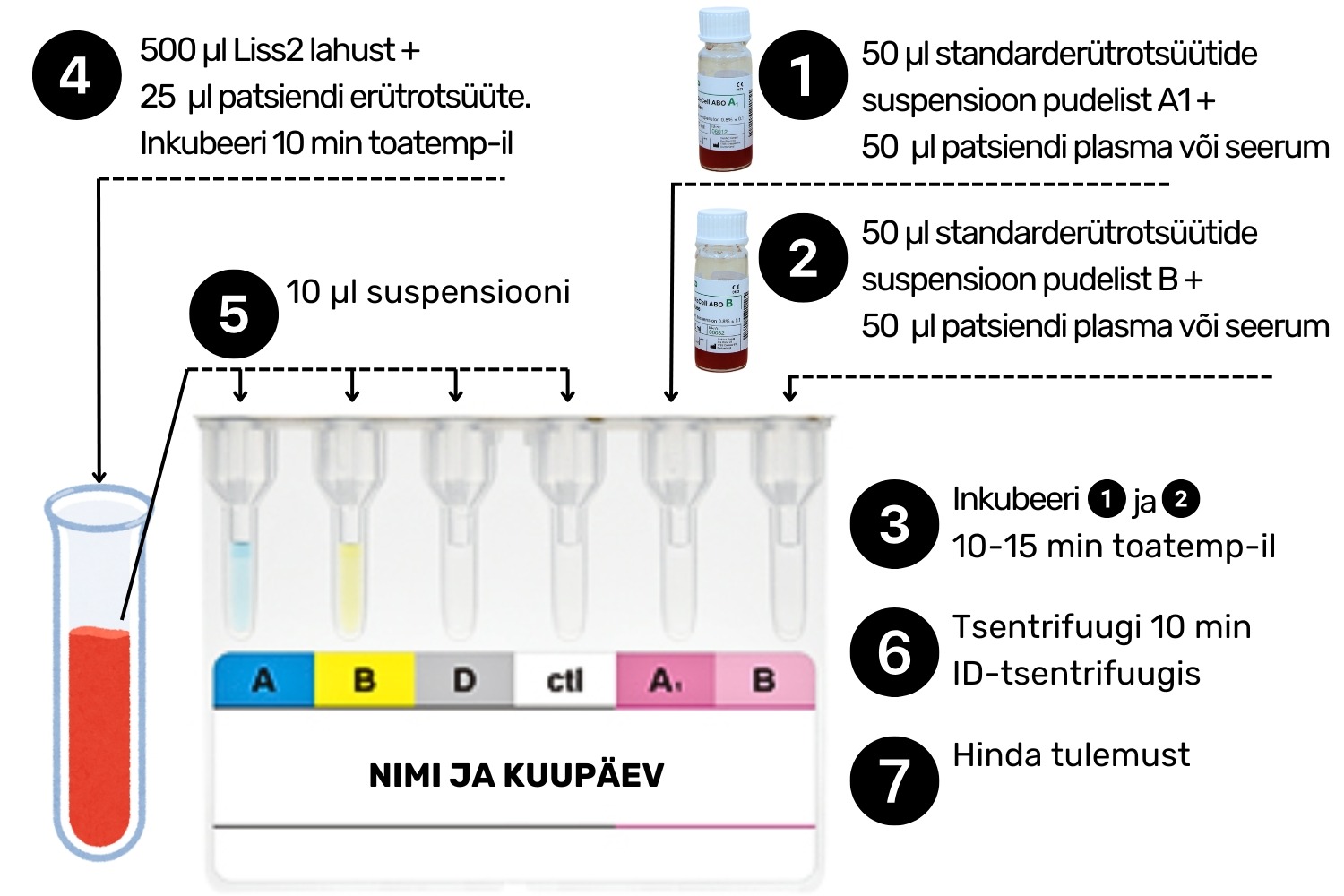
- Pipeteeri vasakult paremale lugedes geelkaardi viiendasse A1 tähisega küvetti 50 μl standarderütrotsüüte pudelist A1 ja kuuendasse B tähisega küvetti 50 μl standarderütrotsüüte pudelist B (Joonis 4).
- Pipeteeri nii A1 kui ka B küvetti 50 μl patsiendi plasmat või seerumit.
- NB! Pipeteeri lahused vastu küveti seina (Joonis 3).
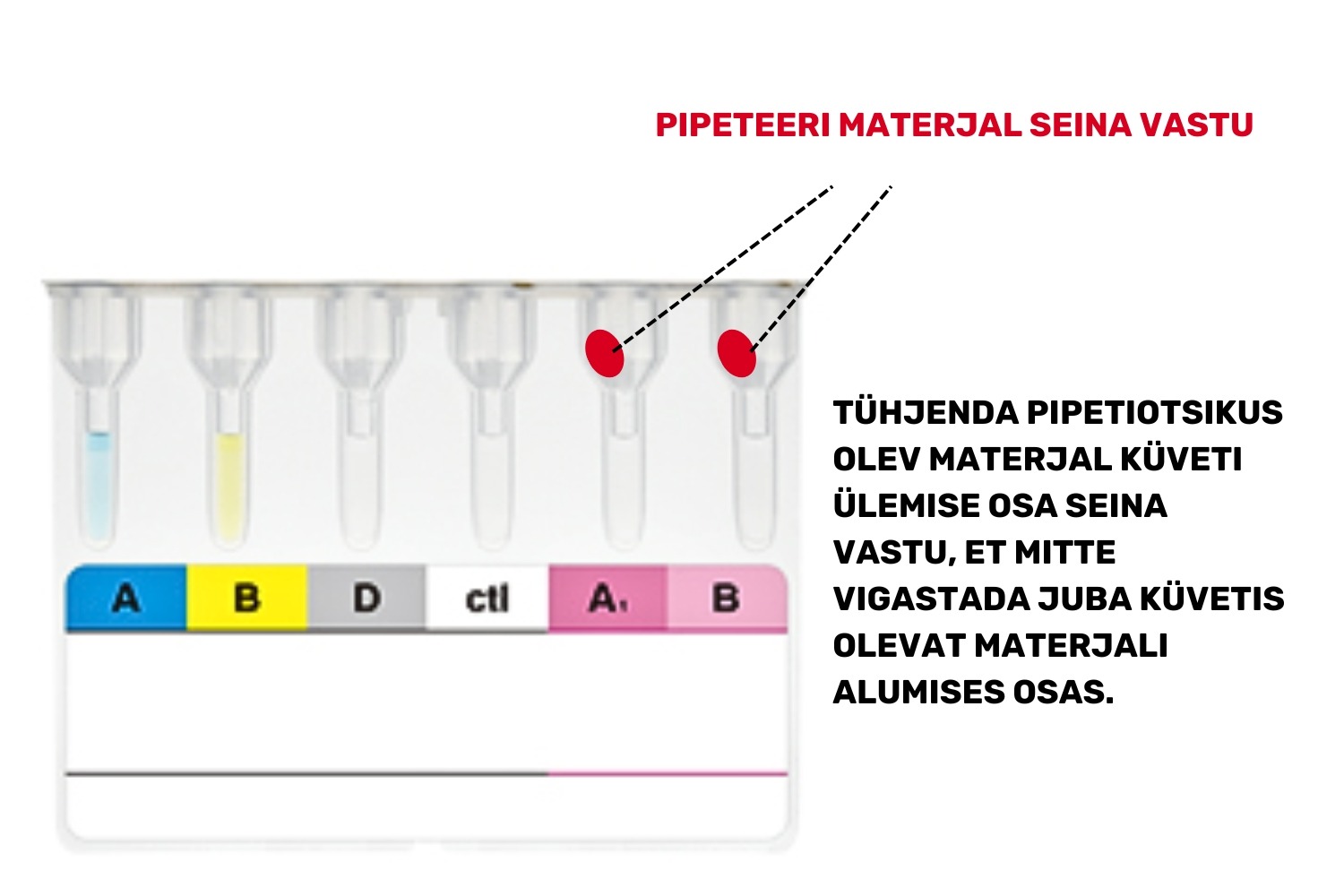
- Kata küvetid fooliumribaga ja jäta geelkaart inkubeerima toatemperatuurile 10-15 minutiks (kasuta taimerit).
- Samal ajal tee valmis Liss2 lahusest ja patsiendi erütrotsüütidest suspensioon: Doseeri katsutisse 500 μl Liss2 lahust (Joonis 2). NB! Üks dispenseri vajutus võrdub 500 μl.
- Lisa 25 μl patsiendi erütrotsüüte (kasutades tsentrifuugitud ja plasma/seerumi eraldamise järgset proovimaterjali) või 50 μl täisverd (kasutades tsentrifuugimata ja plasmat/seerumit eraldamata proovimaterjali). Suspendeeri segu ühtlaseks pipetiga või liiguta katsutit ringjalt.
- Jäta suspensioon seisma toatemperatuurile ca 10 minutiks.
- Sega uuesti (punktis 8.2.6.) valmistatud erütrotsüütide suspensioon ühtlaseks ning pipeteeri sellest 10 μl esimesse, teise, kolmandasse ja neljandasse geelikaardi küvetti (Joonis 4) .
- Kata küvetid fooliumribaga, nii et see jääks sinna püsima.
- Tsenterifuugi geelkaart.
1.10.9.3. Tsentrifuugimine:
- Aseta geelkaart ID-tsentrifuugi (Joonis 5) kaardihoidjasse nii, et oleks tagatud tasakaal (vajadusel kasuta tasakaalustamiseks tühja geelkaarti). Soovitatav on paigutada kaart nii, et fooliumriba avatav ots jääb väljapoole. See väldib tsentrifuugimisel kaardi takerdumist, kui kaart pöördub 90 kraadise nurga alla.

- Sulge tsentrifuugi kaas ja vajuta START nuppu, et käivitada tsentrifuugimistsükkel (10 minutit, pöörete arv 1175).
- Ebaühtlase kaartide jaotamise korral lülitab tsentrifuug end 5-10 sek jooksul välja ja süttib ALARM tuli. Sellisel juhul ava kaas ja paiguta kaardid tasakaalu.
- Katkestusteta kulgenud tsentrifuugimistsükli (10 minutit) lõppedes avaneb tsentrifuugikaas automaatselt.
- Võta ID-kaart tsentrifuugist välja statiivile ja hinda tulemusi.
1.10.9.4. Tulemuste hindamine:
- Peale tsentrifuugimist on näha küvettides geeli pinnal (positiivne tulemus) või põhjas (negatiivne tulemus) erütrotsüütidest moodustunud punane kriips. Vastavalt sellele määratakse patsiendi ABO- ja Rh-veregrupp (Tabel 1 ja Joonis 6).
- Geelkaardi neljas küvett Ctl (kontroll) peab andma alati negatiivse tulemuse (Joonis 6). Kui nii on, siis võib jätkata tulemuse hindamisega, kui nii ei ole, siis on uuring ebaõnnestunud ja mitteusaldusväärne ning analüüsi tuleb korrata.
- Patsiendi ABO-veregrupi määramisel tuleb hinnata komplekssena kahte esimest (otsene reaktsioon) ja kahte viimast küvetti (pöördreaktsioon): kahe viimase küveti visuaalne tulemus (erütrotsüütide paiknemine) peab olema vastupidine esimese kahe küveti tulemusele (kui otsese reaktsiooni korral on tulemus positiivne, siis pöördreaktsiooni korral peab tulemus sama tähisega küvetis olema negatiivne).
- Kui esimese või teise küveti puhul moodustub kriips geeli pinnale, siis on tegemist vastava veregrupiga kas A, B või AB. Kui kriips moodustub küveti põhja, nii A kui ka B küvetis, siis on tegemist 0 grupiga.
Selgitus: Reaktsioon põhineb antigeen-antikeha reaktsioonil. Esimesed 2 küvetti sisaldavad vastavalt anti-A ja anti-B immuunglobuliine, mis regeerivad erütrotsüütide pinnal olevate antigeenidega. Reaktsiooni tulemusena moodustunud erütrotsütaarsed kogumikud ei pääse tsentrifuugimisel geelist läbi ja jäävad geeli pinnale või osaliselt geeli sisse (alagruppide esinemisel). Kui patsiendi erütrotsüütidel ei ole reaktsiooni toimumiseks vajalikke antigeene, siis kogumikke ei teki ja erütrotsüüdid liiguvad tsentrifuugimise käigus läbi poorse geeli küveti põhja.
- Kaardi viienda ja kuuenda küveti tulemus põhineb pöördreaktsioonil, mistõttu peab tulemus olema täpselt vastupidine esimesele kahele küvetile. Näiteks kui esimestes küvettides moodustub kriips A ja/või B küveti puhul geeli pinnal, siis viimastes küvettides peab kriips moodustuma A ja/või B puhul küveti põhja
Selgitus: Pöördreaktsiooni küvettides toimub reaktsioon standarderütrotsüütide pinnal paiknevate grupispetsiifiliste antigeenide ja patsiendi plasmas/seerumis olevate loomulike antikehade anti-A ja anti-B vahel. Kui näiteks patsiendil on A veregrupp, siis viiendas küvetis reaktsiooni ei toimu, sest patsiendi seerum ei sisalda antikehasid A-antigeeni vastu ja kriips tekib küveti põhja, vastupidiselt võrreldes esimese küvetiga.
| Veregrupp | Otsese reaktsi korral | Pöördreaktsiooni korral | ||
| A küvett | B küvett | A1 küvett | B küvett | |
| A | pos | neg | neg | pos |
| B | neg | pos | pos | neg |
| AB | pos | pos | neg | neg |
| O | neg | neg | pos | pos |
Tabel 1. ABO veregrupi hindamine.
- Kolmas küvett DVI- näitab patsiendi Rh-kuuluvust. Kui punane kriips on geeli pinnal, siis on tegemist Rh(D) positiivse prooviga ning kui punane kriips on küveti põhjas, siis on tegemist Rh(D) negatiivse prooviga.
Selgitus: Reaktsioon põhineb samuti antigeen-antikeha reaktsioonil. Küvett märgistusega DVI- sisaldab D antigeeni vastast immunoglobuliini, mis reageerib D antigeeni sisaldavate erütrotsüütidega ning reaktsiooni tulemusena moodustunud kogumikud ei pääse tsentrifuugimisel geelist läbi ja jäävad seetõttu geeli pinnale või osaliselt geeli sisse.
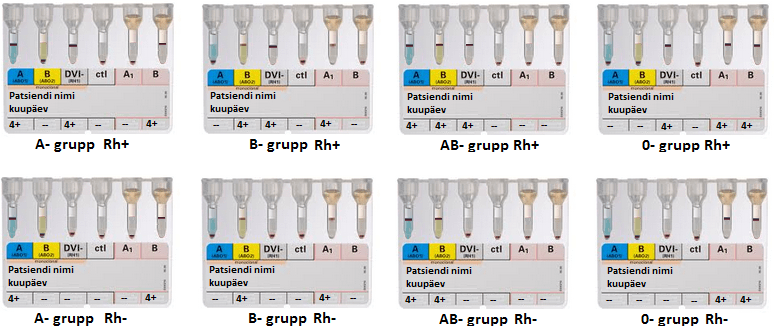
1.10.9.5. Tulemuste esitamine:
- Võimalikud veregrupid: A, B, AB või O
- Rh(D) kuuluvus: Positiivne või Negatiivne
1.10.10. TÖÖ LÕPETAMINE
- Töö lõpetades korrasta ja desinfitseeri oma töökoht, ID-tsentrifuug
- Lülita ID-tsentrifuug vooluvõrgust välja.
- Pane reagendid ja Liss2 lahus külmikusse.